II.8. Sinteză recapitulativă - Substanțe. Amestecuri de substanțe
Substanța pură are o compoziție bine determinată, are constante fizice specifice și își păstrează compoziția în urma unor fenomene fizice.
Pentru a exprima cât de curată este o substanță se folosește noțiunea de puritate.
Puritatea (p) reprezintă masa de substanță pură care se găsește în 100g de substanță impură. Ea se exprimă în procente (%).
Amestecul este rezultatul punerii în comun a două sau mai multe substanțe între care nu au loc fenomene chimice (reacții chimice).
Amestecurile au următoarele caracteristici :
-
A) Un amestec este format din doi sau mai mulți componenți.
-
B) Substanțele componente pot fi luate în diferite proporții.
-
C) Fiecare substanță componentă își păstrează proprietățile fizice și chimice.
După compoziția lor, amestecurile se clasifică în :
1. Amestecuri omogene care au aceeași compoziție și aceleași proprietăți în toată masa lor.
Exemple de amestecuri omogene:
- soluții;
- aliaje;
- oțet;
- aer;
- spirt etc.
2. Amestecuri eterogene care nu au aceeași compoziție și aceleași proprietăți în toată masa lor și se observă cu ochiul liber sau cu lupa componenții săi.
Exemple de amestecuri eterogene:
- apă cu nisip;
- apă cu pietriș;
- preparate culinare;
- roci etc.
Metode de separare a amestecurilor omogene
I.Cristalizarea este metoda de separare a unei substanțe solide sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea substanței lichide.
-
Aplicațiile cristalizării :
-
Extragerea sării din apa de mare.
-
Extragerea zahărului din trestia/sfecla de zahăr.
-
II.Distilarea constă în separarea componentelor lichide dintr-un amestec omogen, pe baza punctelor lor de fierbere diferite. În timpul distilării au loc două fenomene fizice: vaporizarea, urmată de condensare.
-
Aplicațiile distilării:
-
Obținerea apei distilate (pură din punct de vedere chimic), folosită în laboratoare, industrie, farmacie.
-
Obținerea băuturilor alcoolice în instalații industriale cu alambic.
-
Prin distilarea fracționată a petrolului, în rafinăriile petrochimice se obțin propan, butan, benzine, petrol lampant, motorină, păcură.
-
Distilarea fracționată a aerului, cu separarea azotului de oxigen.
-
Metode de separare a componentelor unui amestec eterogen
I. Decantarea este metoda de separare a componentelor unui amestec eterogen solid – lichid sau lichid –lichid pe baza diferenței mari dintre densitățile acestora.
a) Pentru componente solid-lichid având densități cu mult diferite, se folosește decantarea cu ajutorul baghetei (când solidul stă la fundul lichidului).
b) Pentru componentele lichid-lichid cu densități diferite, se folosește pâlnia de separare.
-
Aplicațiile decantării :
-
Obținerea apei potabile în bazine decantoare de mari dimensiuni, în care impuritățile solide se depun pe fundul decantorului și apa se limpezește și se epurează (curăță) mecanic.
-
Separarea celor 2 componente ale varului stins: apa de var și laptele de var.
-
II.Filtrarea este metoda de separare a unei substanțe solide dintr-un amestec eterogen solid-lichid, cu ajutorul unui material filtrant.
Observație:
Când densitatea solidului este mult mai mare ca cea a lichidului din amestec, aplicăm decantarea, iar când densitatea solidului este asemănătoare cu cea a lichidului (solidul nu se depune la fundul lichidului, ci este peste tot împrăștiat prin lichid), aplicăm filtrarea.
-
Aplicațiile filtrării:
-
Filtru pentru apă potabilă (bună de băut)
-
Filtru pentru aer (automobile, aer condiționat, aspiratoare, industriale pentru reținerea gazelor poluante etc.)
-
Filtru de ulei la automobile
-
Filtru de cafea
-
Solul – partea exterioară a scoarței terestre - este un amestec eterogen de materie organică (rădăcini de plante, mici organisme, resturi de vietăți aflate în descompunere care formează humusul) și materie anorganică (roci, apă, oxigen, dioxid de carbon, azot).
Principalele tipuri de sol:
- solul nisipos,
- solul argilos,
- solul calcaros.
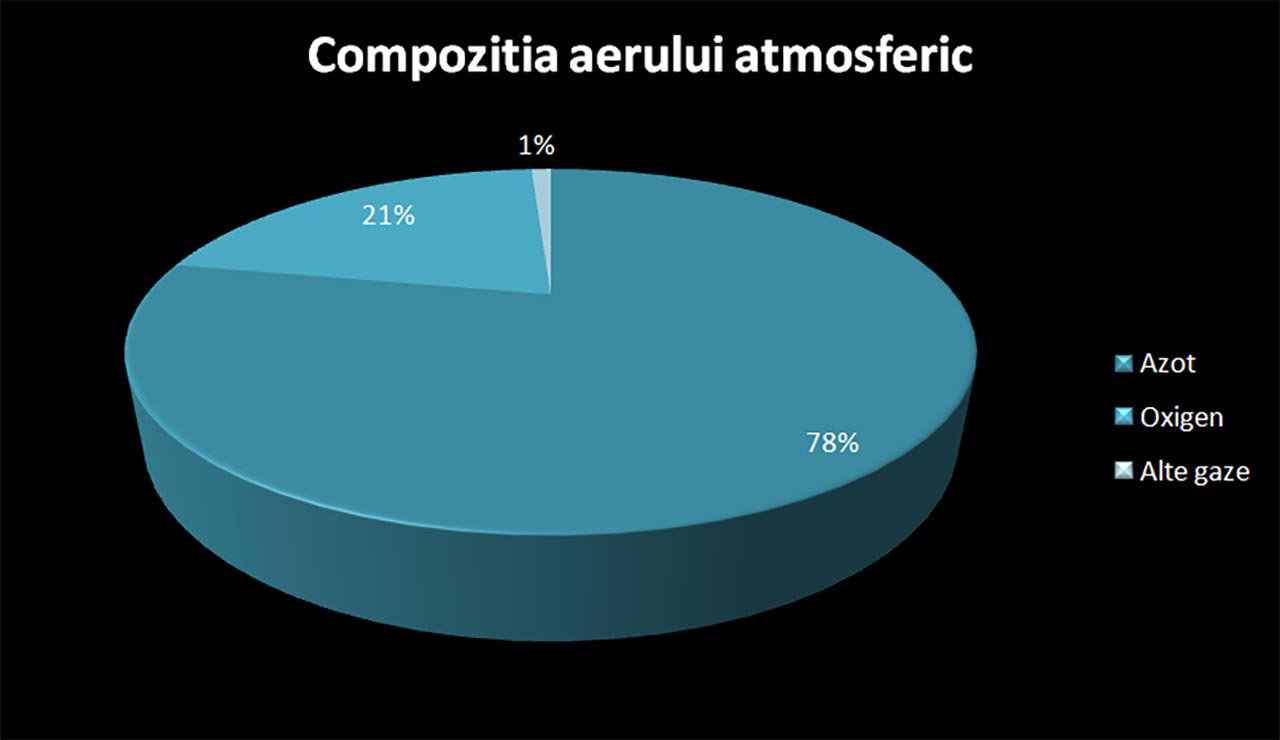
Aerul – amestec omogen care înconjoară Pământul - conține azot (nitrogen) molecular diatomic (N2) în proporție de 78 %, oxigen molecular diatomic (O2) -21 %, argon (Ar) (0,92 %), dioxid de carbon (CO2) -0,04 %, ozon sau oxigen triatomic (O3) și alte gaze, praf, fum etc.
Hidrosfera este învelișul de apă al Pământului, fiind formată din oceane, mări, lacuri, râuri, ape subterane, ghețari și reprezintă 70% din suprafața totală a planetei noastre.
Dizolvarea este fenomenul fizic în urma căruia o substanță se răspândește uniform printre particulele altei substanțe, rezultând un amestec omogen.
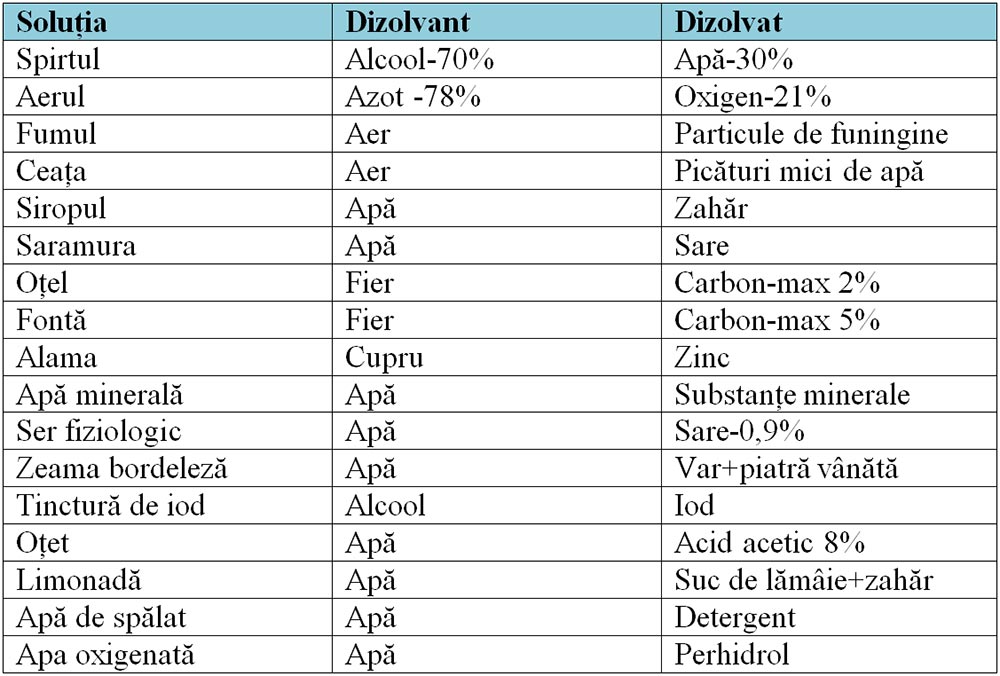
Soluția este amestecul omogen de substanțe obținut în urma dizolvării.
Soluția este formată din două componente :
1) Dizolvat (solvat, solut) este substanța în cantitate mai mică. Exemple: sarea, zahărul, piatra vânătă.
2) Dizolvant (solvent) este substanța în cantitate mai mare. Exemple: apa, alcoolul, eterul, benzina, acetona.
Soluțiile în care dizolvantul este apa, cel mai utilizat, se numesc soluții apoase.
Masele componentelor unei soluții se conservă (rămân aceleași), adică masa soluției este egală cu suma, maselor dizolvatului și a dizolvantului.
Exemple de cele mai cunoscute soluții:
Factorii care grăbesc dizolvarea unui solid într-un lichid sunt:
-
dimensiune cât mai mică a particulelor (cristalelor)
-
temperatură mai mare
-
agitarea componentelor.
Solubilitatea este proprietatea unei substanțe de a se dizolva într-un anumit solvent. Coeficientul de solubilitate măsoară masa maximă de substanță care se dizolvă în 100 g de solvent, la o anumită temperatură.
Solubilitatea depinde atât de natura dizolvantului, cât și de natura dizolvatului.
Clasificarea substanțelor după solubilitatea în apă:
a) Substanțe ușor solubile (piatra vânătă, sarea, zahărul).
b) Substanțe greu solubile (carbonatul de magneziu, var stins, oxigenul, iodul).
c) Substanțe insolubile (metalele, sulful, cărbunele, uleiul, plasticul etc.).
Factorii care influențează solubilitatea substanțelor :
-
Natura solutului şi a solventului este un prim factor care influențează solubilitatea substanțelor.
-
Temperatura este un alt factor care influențează solubilitatea substanțelor. În general, cu creșterea
-
temperaturii, creşte solubilitatea substanțelor solide şi lichide şi scade solubilitatea gazelor.
-
Presiunea influențează solubilitatea gazelor. Cu creșterea presiunii, creşte solubilitatea substanțelor gazoase în solvenții lichizi.
Clasificarea soluțiilor după masa de substanță dizolvată :
-
I. Soluții nesaturate
- diluate: conțin o masă mică de dizolvat
- concentrate: conțin o masă mare de dizolvat
-
II. Soluții saturate: conțin masa maximă de dizolvat la o temperatură dată, fiind egală cu solubilitatea substanței respective.
-
III. Soluții suprasaturate: conțin mai multă masă de dizolvat decât solubilitatea acestuia la temperatura dată.
Concentrația procentuală de masă ( c ) reprezintă masa de substanță dizolvată în 100g soluție.

Unde md = masa dizolvatului,
ms = masa soluției = md + mapă
Observație:
a) Concentrația procentuală de masă (c) se exprimă în procente (%). Deci, o soluție de sare de concentrație 25% arată că 25 g sare sunt dizolvate în 100 g soluție și nu 100 g apă ca la solubilitate.
b) O soluție se poate concentra prin:
-
Adăugare de solvat (dizolvat).
-
Îndepărtarea prin evaporare a unei mase de apă din soluție.
-
Adăugarea unei soluții de același tip, dar cu concentrație mai mare.
c) O soluție se poate dilua prin:
-
Adăugare de apă.
-
Adăugarea unei soluții de același tip, dar mai diluată.