III.4. Învelișul de electroni
Modelul "planetar" al atomului folosește asemănarea dintre Soare și nucleul atomului și planetele care se rotesc în jurul Soarelui cu electronii din învelișul electronic.


Învelișul electronic reprezintă totalitatea electronilor care orbitează în jurul nucleului.
Electronii realizează două tipuri de rotații:
-
în jurul nucleului
-
în jurul propriilor axe.
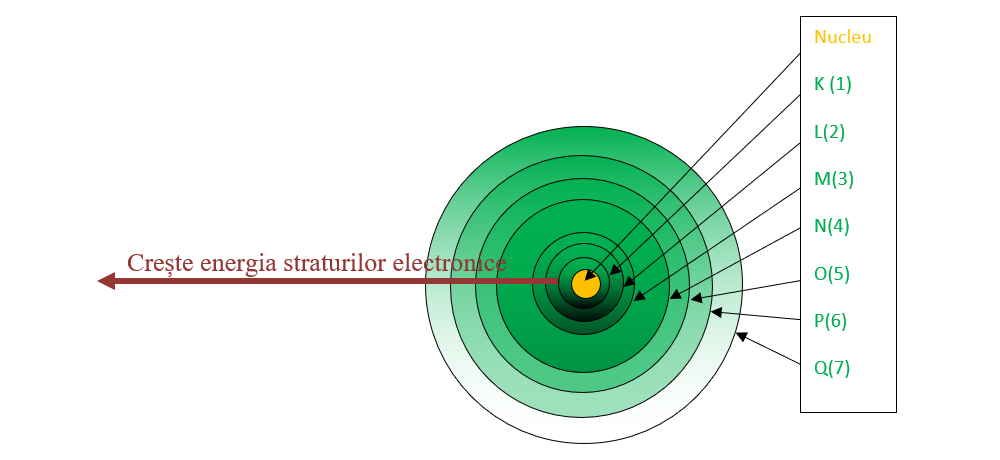
Învelișul electronic are o structură stratificată, fiind format din șapte straturi (nivele) concentrice nucleului și numerotate de la nucleu către exterior cu 1, 2, 3, 4, 5, 6 şi 7 sau cu litere începând de la litera K (K, L, M, N, O, P și Q).
Într-un atom, electronii tind să ocupe pozițiile cele mai stabile, caracterizate de energia cea mai mică. Energia straturilor crește de la primul strat din jurul nucleului spre exterior. Aceasta este și ordinea de repartizare a electronilor pe straturi.
Toți electronii sunt identici pentru că au aceeași masă (9,1 ∙ 10-31 kg), aceleași dimensiuni, aceeași sarcina electrică (q = - 1,6 ∙ 10-19 C).
Forțele de atracție electrostatică dintre nucleul încărcat pozitiv și electronii încărcați negativ, explică mișcarea acestora în jurul nucleului.
Caracteristicile învelișului electronic:
-
volum mare, în comparație cu volumul nucleului.
-
masă mică, electronii având masă neglijabilă.
-
încărcat cu sarcini negative.
Repartiția pe straturi a celor Z electroni ai unui atom reprezintă structura electronică a atomului.
Ocuparea straturilor cu electroni respectă anumite reguli:
-
electronii ocupă straturile în ordine, începând de la cel mai apropiat de nucleu;
-
fiecare strat conține un număr limitat de electroni;
-
numărul maxim de electroni de pe un nivel energetic este dat de formula:
nr max ē = 2n2,
unde n = nr. stratului
Exemplu
a) pentru stratul K, n=1, nr max ē = 2n2 = 2 ∙ 12 = 2 electroni
b) pentru stratul L, n=2, nr max ē = 2n2 = 2 ∙ 22 = 8 electroni
c) pentru stratul M, n=3, nr max ē = 2n2 = 2 ∙ 32 = 18 electroni
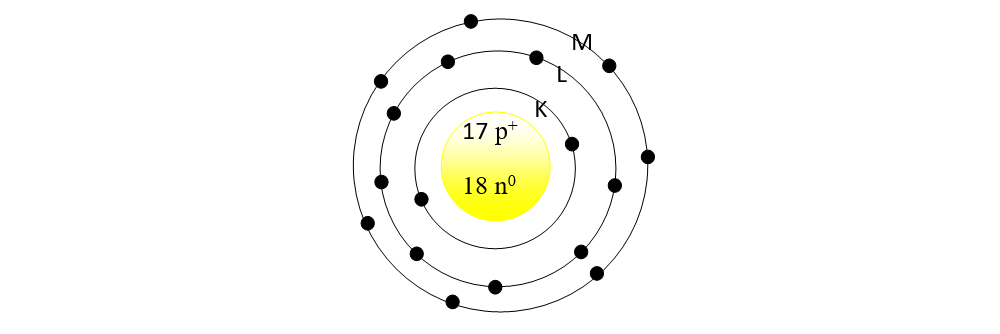
1. Reprezintă structura atomului de

Rezolvare:
-
În mijloc reprezentăm nucleul cu protoni ( Z = 17 = nr. p+) și neutroni ( N = A - Z = 35- 17 = 18 = nr. n0)
-
În jurul nucleului reprezentăm:
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 7ē.
-
În total trebuie să avem 17 ē, întrucât Z = 17 = nr. electroni din învelișul electronic.
-
Straturile neocupate cu electroni nu se mai desenează.
2. Reprezintă structura atomului de

Rezolvare:
-
În mijloc reprezentăm nucleul cu protoni ( Z = 13 = nr. p+) și neutroni ( N = A - Z = 27 - 13 = 14 = nr. n0)
-
În jurul nucleului reprezentăm:
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 3ē.
-
În total trebuie să avem 13 ē, întrucât Z = 13 = nr. electroni din învelișul electronic.
-
Straturile neocupate cu electroni nu se mai desenează.

Doi electroni pe primul strat, K, este o configurație stabilă, numită dublet.
Opt electroni pe celelalte straturi, L-Q, este o configurație stabilă, numită octet.
Elementele a căror atomi au structuri stabile pe ultimul strat, de dublet sau octet, se numesc gaze rare.
I. Alege varianta corectă:
1) Nr. maxim de electroni de pe stratul M este:
a) 8;
b) 2;
c) 18;
d) 12.
2) Care atom are configurație stabilă de octet:
a) magneziu;
b) sulf;
c) heliu;
d) calciu.
3) Atomul căruia îi lipsesc 3 electroni pentru a avea configurația stabilă de octet pe stratul M:
a) Este azot;
b) Are Z = 9;
c) Are 5n0;
d) Are A = 17.
4) Câți electroni se găsesc în 2g Na cu ANa = 23 g/mol ?