I.6. Formarea ionilor și a compușilor ionici
Elementele chimice care se găsesc sub formă de atomi liberi stabili sunt cele șase gaze nobile (rare) din grupa a VIII a A (sau grupa nr.18) a Tabelului periodic : Heliu(He), Neon(Ne), Argon(Ar), Kripton(Kr), Xenon(Xe) și Radon(Rn), având configurație stabilă a ultimului strat de dublet (He) sau octet (celelalte gaze rare).
Atomii celorlalte elemente se unesc între ei pentru a obține forme stabile, ioni sau molecule.
Proprietatea caracteristică a atomilor de a se uni între ei se numește valență.
Electronii periferici (de pe ultimul strat, numit strat de valență) care contribuie la formarea legăturilor dintre atomi se numesc electroni de valență.
Atomii metalelor, având un număr mic de electroni pe ultimul strat, cedează acești electroni și ajung la configurația stabilă a penultimului strat, la fel cu cea a gazului rar precedent lui în Sistemul periodic.
Prin cedare de electroni atomii metalelor devin ioni pozitivi (cationi), deoarece vor avea un surplus de protoni în nucleu. Spunem că metalele au un caracter electropozitiv.
Formarea ionilor pozitivi:
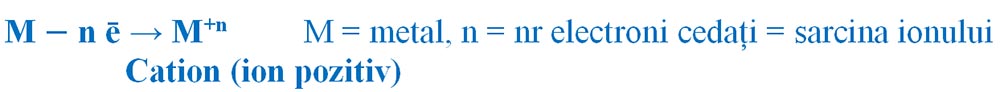
- Metalele din grupa 1 (IA) au 1 ē de valență pe care îl cedează, formând ioni pozitivi cu sarcina +1.

- Metalele din grupa a 2 a (a II-a A) au 2 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +2.

- Metalele din grupa a 13 a (a III-a A) au 3 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +3.

Atomii nemetalelor, având un număr mare de electroni pe ultimul strat, acceptă electroni pentru a forma octet stabil pe stratul de valență, identic cu cea a gazului rar ulterior lui în Sistemul periodic.
Prin acceptare de electroni atomii nemetalelor devin ioni negativi (anioni), deoarece vor avea un surplus de electroni în înveliș. Spunem că nemetalele au un caracter electronegativ.
Formarea ionilor negativi:
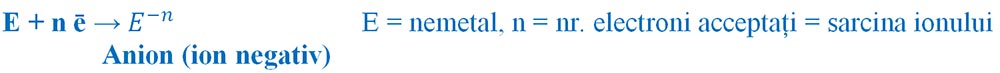
- Nemetalele din grupa a 15 a (aVA) au 5 ē de valență și trebuie să accepte 3 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 3.

- Nemetalele din grupa a 16 a (aVIA) au 6 ē de valență și trebuie să accepte 2 ē pentru a ajunge la configurația
- stabilă de octet, formând ioni negativi cu sarcina - 2.

- Nemetalele din grupa a 17 a (a VIIA) au 7 ē de valență și trebuie să accepte 1 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 1.

Ionii sunt specii (particule) chimice încărcate cu sarcini electrice (deoarece numărul electronilor din înveliș este diferit de numărul protonilor din nucleu) provenite din atomi sau grupe de atomi, prin cedare sau acceptare de unul sau mai mulți electroni.
Nucleul ionului format este identic cu cel al atomului din care provine.
Valența egală cu numărul electronilor cedați sau acceptați se numește electrovalență.

Denumirea ionilor:
-
Pozitivi (cationilor): "ion de (numele metalului)". Exemplu: ion de magneziu Mg(+2).
-
Negativi (anionilor): “ion de (numele nemetalului)" + terminația "ură". Exemplu: ion clorură Cl(-1). Pentru anionul O(-2) avem denumirea de "oxid de".
Când ne referim la caracterul chimic al unui element spunem ce este, adică metal sau nemetal.
Când ne referim la caracterul electrochimic al unui element spunem ce fel de ioni formează, pozitivi sau negativi.
Prin urmare:
-
Metalele au caracter chimic metalic și caracter electrochimic electropozitiv.
-
Nemetalele au caracter chimic nemetalic și caracter electrochimic electronegativ.
Compușii ionici se formează în două etape:
-
Transfer de electroni (ē) de la metale la nemetale cu formarea ionilor pozitivi și negativi.
-
Atracția electrostatică între ionii de semn opus, fiind legătura chimică (legătură ionică) care se stabilește între ionii de semn contrar. Se formează un compus ionic stabil și neutru din punct de vedere electric (nr. sarcini pozitive = nr sarcini negative), întotdeauna între două elemente cu caracter diferit (metale cu nemetale).
Exemple:
a) Sarea de bucătărie: Clorura de sodiu: NaCl
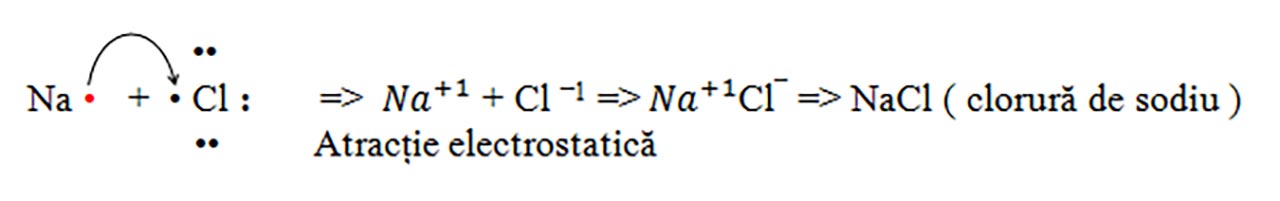
b) Clorura de magneziu: MgCl2
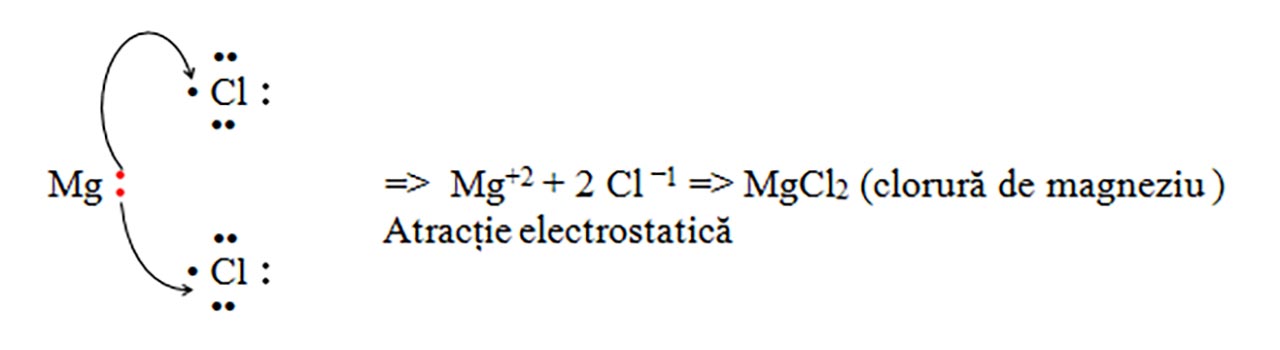
c) Clorura de aluminiu: AlCl3
