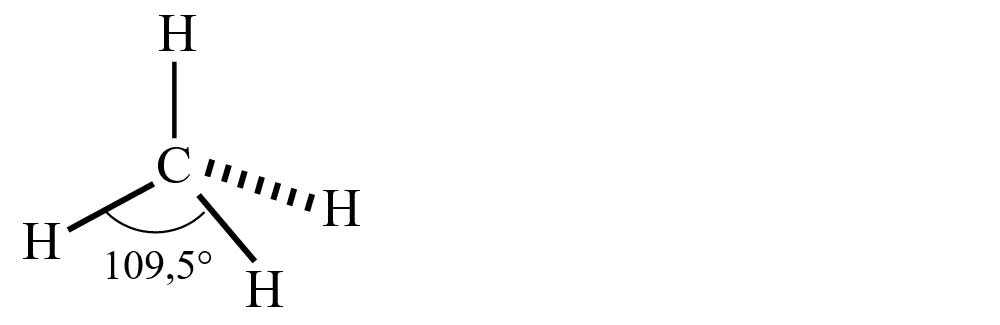I.7. Molecule. Formarea moleculelor
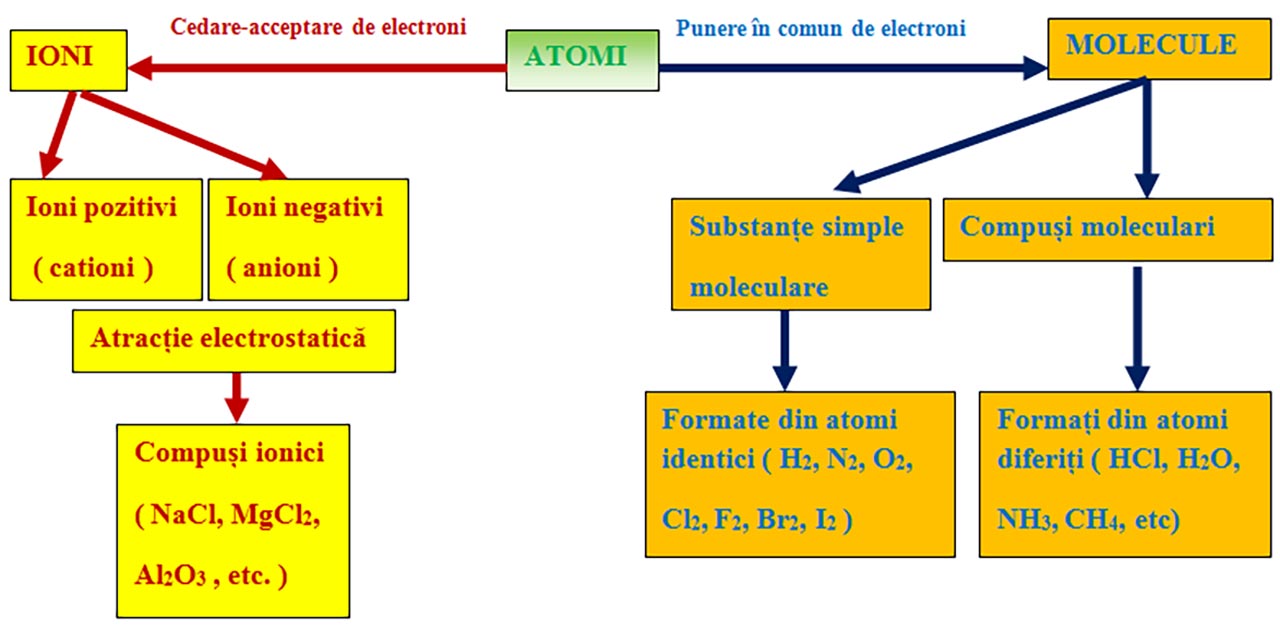
Atomii cu același caracter chimic (nemetalele) pot ajunge la configurația stabilă de dublet sau octet punând în comun electronii de valență și formând molecule.
În molecule legătura obținută prin punerea în comun de electroni se numește legătură covalentă.
Molecula reprezintă cea mai mică particulă dintr-o substanță, care poate exista și în stare liberă și care, păstrează proprietățile substanței din care provine.
Caracteristicile moleculelor:
-
Particule stabile.
-
Particule electric neutre.
-
Au forme și dimensiuni diferite.
-
Între molecule există spații intermoleculare.
-
Moleculele se mișcă dezordonat în funcție de temperatură.
-
Moleculele aceleiași substanțe sunt identice.
-
Reprezintă grupări de atomi identici sau diferiți.
I. După felul atomilor care participă la formarea legăturii, aceasta poate fi:
1) Legătură covalentă nepolară prin punerea în comun de electroni între atomi identici. Se formează substanțe simple moleculare (H2, N2, O2, F2, Cl2, Br2, I2)
Exemple:
- a) formarea moleculei de hidrogen (H2):
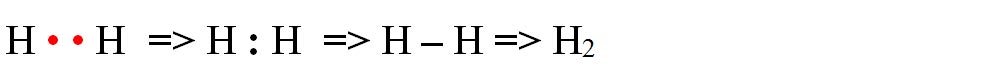
- b) formarea moleculei de clor (Cl2):
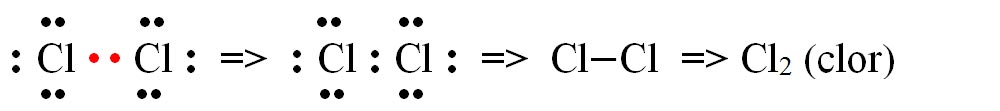
În mod identic se formează și moleculele de F2 (fluor), I2 (iod) și Br2 (brom).
2) Legătură covalentă polară prin punerea în comun de electroni între atomi diferiți.
Exemple:
a) formarea moleculei de acid clorhidric (HCl)
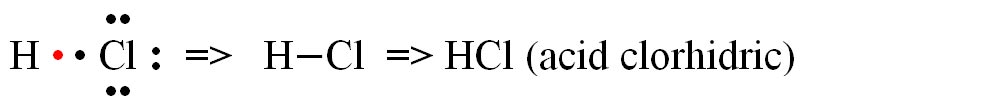
b) formarea moleculei de apă (H2O)
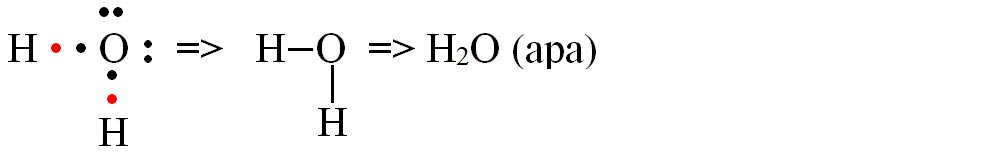
- Modelul spațial al moleculei de apă (H2O)

c) formarea moleculei de amoniac (NH3)
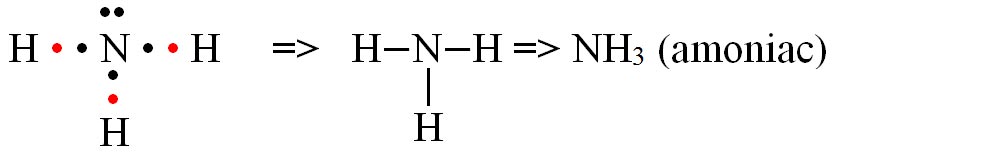
- Modelul spațial al moleculei de amoniac (NH3)

d) formarea moleculei de metan (CH4)
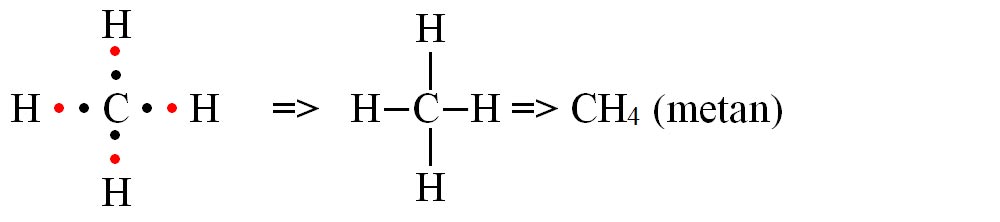
- Modelul spațial al moleculei de metan (CH4)