III.5. Sinteză recapitulativă - Atomul
Atomul este cea mai mică particulă dintr-o substanță care nu mai poate fi divizată prin procedee chimice obișnuite.
Structura atomului:
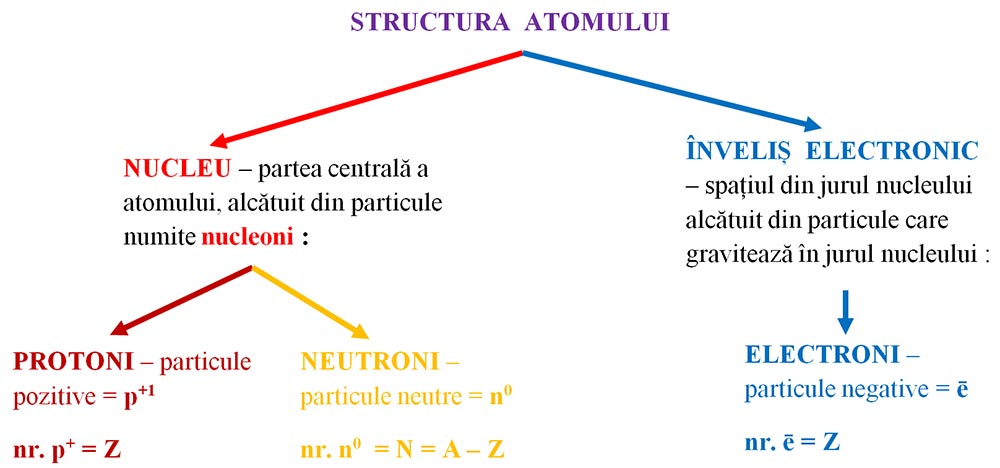
1. Nucleul este partea centrală a atomului, alcătuit din particule numite nucleoni, și anume:
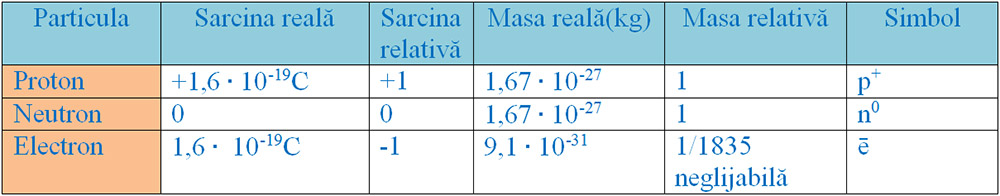
- Protoni, particule încărcate cu sarcină pozitivă, cu simbolul p+1.
- Neutroni, particule neutre din punct de vedere electric, cu simbolul n0.
2. Învelișul electronic este spațiul din jurul nucleului format dintr-un nor de particule numite electroni care gravitează în jurul nucleului. Electronii sunt particule cu sarcină negativă, cu simbolul e-1 sau ē.
Prin frecarea dintre două corpuri, acestea se electrizează și se încarcă electric cu sarcini pozitive sau negative.
Sarcina electrică, q, este o mărime fizică ce măsoară starea de electrizare a unui corp și se măsoară în C (coulomb).
Cea mai mică sarcină este sarcina electronului, notată cu qe și egală cu (-1,6) ∙ 10-19 C. Ea este egală cu sarcina protonului și de semn opus. Sarcina unui proton (respectiv electron) se numește sarcină electrică elementară (qe).
Sarcina unui corp (Q) este un multiplu întreg al sarcinii electrice elementare:

n = nr.întreg și qe = sarcină electrică elementară = 1,6 ∙ 10-19 C.
Caracteristici ale particulelor elementare (subatomice):
Atomul este o particulă neutră din punct de vedere electric, deoarece are numărul de protoni din nucleu (particule pozitive) egal cu numărul de electroni din învelișul electronic (particule negative), adică

Pentru un atom definim numărul atomic (numit și sarcina nucleară sau nr. de ordine), Z, care reprezintă numărul de protoni din nucleu și care este egal cu numărul de electroni din înveliș:

Pentru orice atom se defineşte numărul de masă, A, care reprezintă numărul total de protoni şi neutroni din nucleul atomic. El reprezintă un număr întreg notat cu A:

Numărul de neutroni din nucleu, N:

Element chimic
Elementul chimic reprezintă totalitatea atomilor care au același număr atomic Z.
În prezent se cunosc 118 elemente chimice. Fiecare are o denumire și o notație prescurtată.
Simbolul chimic este litera sau grupul de două litere cu care se notează în mod convențional un element chimic.
Simbolul chimic are o dublă semnificație:
a) Calitativă - reprezintă un anumit element chimic
b) Cantitativă - la scară atomică, reprezintă un atom al elementului respectiv.
Un element chimic cu simbolul E se notează astfel:

Izotopii sunt speciile de atomi cu același număr atomic Z, dar cu numărul de masă A diferit.
Masa atomică. Mol de atomi.
Unitatea atomică de masă (u.a.m.) reprezintă a 12-a parte din masa izotopului de carbon,

Masa atomică relativă (A) este numărul care arată de câte ori masa unui atom este mai mare decât unitatea atomică de masă.
Un mol de atomi reprezintă cantitatea dintr-o substanţă care conţine 6,022 ∙ 1023 de atomi. Se notează cu litera grecească "niu"= υ.
Masa unui mol de atomi este egală cu masa atomică a elementului chimic exprimată în grame.
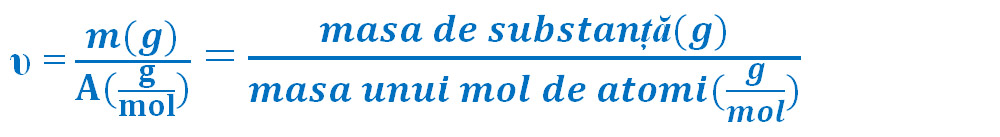
Numărul lui Avogadro, notat cu NA, este egal cu 6,022 ∙ 1023 atomi şi reprezintă numărul de atomi conţinuţi într-un mol de atomi din orice element chimic.
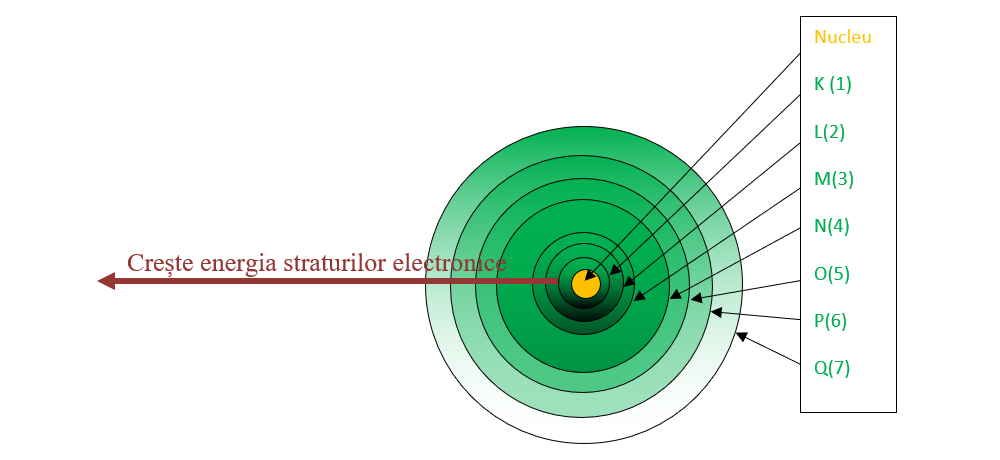
Învelișul electronic reprezintă totalitatea electronilor care orbitează în jurul nucleului atomic.
Învelișul electronic are o structură stratificată, fiind format din șapte straturi (nivele) concentrice nucleului și numerotate de la nucleu către exterior cu 1, 2, 3, 4, 5, 6 şi 7 sau cu litere începând de la litera K (K, L, M, N, O, P și Q).
Într-un atom, electronii tind să ocupe pozițiile cele mai stabile, caracterizate de energia cea mai mică. Energia straturilor crește de la primul strat din jurul nucleului spre exterior. Aceasta este și ordinea de repartizare a electronilor pe straturi.
Toți electronii sunt identici pentru că au aceeași masă (9,1 ∙ 10-31 kg), aceleași dimensiuni, aceeași sarcina electrică (q = - 1,6 ∙ 10-19 C).
Forțele de atracție electrostatică dintre nucleul încărcat pozitiv și electronii încărcați negativ, explică mișcarea acestora în jurul nucleului.
Repartiția pe straturi a celor Z electroni ai unui atom reprezintă structura electronică a atomului.
Ocuparea straturilor cu electroni respectă anumite reguli:
-
electronii ocupă straturile în ordine, începând de la cel mai apropiat de nucleu;
-
fiecare strat conține un număr limitat de electroni;
-
numărul maxim de electroni de pe un nivel energetic este dat de formula:
nr max ē = 2n2,
unde n = nr. stratului
Exemplu:
a) pentru stratul K, n=1, nr max ē = 2n2 = 2 ∙ 12 = 2 electroni
b) pentru stratul L, n=2, nr max ē = 2n2 = 2 ∙ 22 = 8 electroni
c) pentru stratul M, n=3, nr max ē = 2n2 = 2 ∙ 32 = 18 electroni
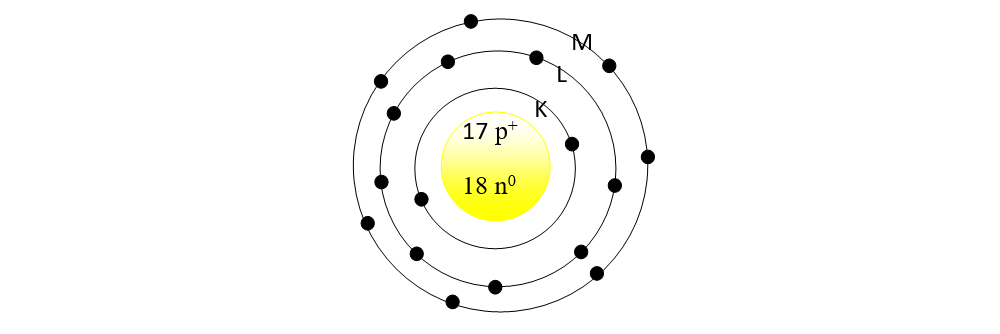
1. Reprezintă structura atomului de

Rezolvare:
-
În mijloc reprezentăm nucleul cu protoni ( Z = 17 = nr. p+) și neutroni ( N = A - Z = 35 - 17 = 18 = nr. n0)
-
În jurul nucleului reprezentăm:
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 7ē.
-
În total trebuie să avem 17 ē, întrucât Z = 17 = nr. electroni din învelișul electronic.
-
Straturile neocupate cu electroni nu se mai desenează.