VI.3.1. Identificarea și separarea anionilor din grupa I a analitică.
Grupa I analitică de anioni: SO4-2, SO3-2, S2O3-2, CO3-2, C2O4-2, F-, PO4-3, BO2-, B4O7-2, AsO3-2, AsO4-3, CrO4-2, Cr2O7-2, SiO3-2 etc.
Toţi anionii din grupa I formează cu Ba2+ săruri puţin solubile în mediu neutru sau slab bazic (BaSO4 este insolubil şi în mediu acid). Ca reactiv de grupă se foloseşte clorura de bariu (soluţie cu concentraţia 2 mol/L), în mediu neutru sau slab bazic. Ionii CrO4-2 colorează soluţia în galben-deschis, iar Cr2O7-2- în galben-portocaliu. Ceilalţi ioni sunt incolori.
👀 Experiment: Identificarea anionului sulfat (SO4-2) cu clorura de bariu
🔥 Atenție! Acidul sulfuric este caustic și îți poate produce arsuri în contact cu pielea !
🔥 Atenție! Clorura de bariu este toxică și nocivă!
Materiale necesare:
Sticlă de ceas sau eprubetă, acid sulfuric, soluție de clorură de bariu, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de acid sulfuric și adaugă apoi puțină soluție de clorură de bariu.
- Ce observi ?
S-a format un precipitat alb cristalin de sulfat de bariu.
Concluzia experimentului:
Ionul sulfat (din acidul sulfuric/sulfați solubili în apă) cu clorura de bariu formează un precipitat alb cristalin conform reacției :
H2SO4 + BaCl2 = BaSO4↓ + 2NaCl
În afară de sulfatul de bariu și sulfatul de stronţiu, respectiv de calciu şi de plumb sunt săruri puţin solubile.
👀 Experiment: Identificarea anionului carbonat (CO3-2) cu azotat de argint
🔥 Atenție! Azotatul de argint este caustic și îți poate produce arsuri în contact cu pielea !
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de azotat de argint, soluție de carbonat de sodiu (poate fi și carbonat de potasiu/carbonat de amoniu), pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de carbonat de sodiu și adaugă apoi soluție de azotat de argint până la precipitare.
- Ce observi ?
S-a format un precipitat alb de carbonat de argint.
Concluzia experimentului:
În urma reacției dintre carbonatul de sodiu și soluția de azotat de argint se formează un precipitat alb de carbonat de argint și azotat de sodiu.
Na2CO3 + 2AgNO3 → Ag2CO3 ↓ + 2NaNO3
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de carbonat de sodiu, soluție de sulfat de magneziu, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de Na2CO3 și adaugă soluție de MgSO4 până la precipitare.
- Ce observi ?
S-a format un precipitat alb de carbonat de magneziu.
Concluzia experimentului:
Sulfatul de magneziu precipită din soluțiile carbonaților, carbonatul de magneziu, un precipitat alb.
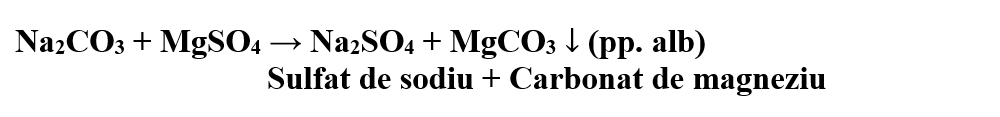
Materiale necesare:
Eprubetă, soluție de bicarbonat de sodiu, soluție de sulfat de magneziu, pipetă, spirtieră, clește de lemn.
Descrierea experimentului:
- Pune în eprubetă câteva picături de soluție de NaHCO3 și adaugă soluție de MgSO4 până la precipitare.
- Încălzește conținutul din eprubetă până la fierbere.
- Ce observi ?
S-a format un precipitat alb de carbonat de magneziu.
Concluzia experimentului:
Sulfatul de magneziu precipită la cald din soluțiile bicarbonaților, carbonatul de magneziu, un precipitat alb.
2 NaHCO3 (aq) + MgSO4 (aq) → 2 CO2 (g) + Na2SO4 (aq) + Mg(OH)2 (s)
CO2 (g) + Mg(OH)2 (s) → H2O (l) + MgCO3 ↓ (pp. alb)
👀 Experiment: Identificarea anionului fosfat (PO4-3) cu azotat de argint
🔥 Atenție! Azotatul de argint este caustic!
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de fosfat de sodiu, soluție de azotat de argint, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de Na3PO4 și adaugă soluție de AgNO3 până la precipitare.
- Ce observi ?
S-a format un precipitat galben de fosfat de argint.
Concluzia experimentului:
Azotatul de argint precipită din soluțiile fosfaților, fosfatul de argint, un precipitat galben. Precipitatul este solubil în acid azotic și exces de amoniac și insolubil în acid acetic.
Na3PO4 + 3 AgNO3 (aq) → 3 NaNO3 (aq) + Ag3PO4 ↓ (pp. galben)
👀 Experiment: Identificarea anionului fosfat (PO4-3) cu clorura de bariu
🔥 Atenție! Clorura de bariu este toxică și nocivă pentru mediu!
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de fosfat de sodiu, soluție de clorură de bariu, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de Na3PO4 și adaugă soluție de BaCl2 până la precipitare.
- Ce observi ?
S-a format un precipitat alb de fosfat de bariu.
Concluzia experimentului:
Clorura de bariu precipită din soluțiile fosfaților, fosfatul de bariu, un precipitat alb.
2 Na3PO4 + 3 BaCl2 (aq) → 6 NaCl (aq) + Ba3(PO4)2 ↓
Dintre fosfați şi hidrogenofosfați sunt solubile numai sărurile de potasiu, sodiu, litiu şi amoniu.
👀 Experiment: Identificarea anionului fosfat (PO4-3) cu acetat de plumb
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de fosfat de sodiu, soluție de acetat de plumb, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de Na3PO4 și adaugă soluție de (CH3COO)2Pb până la precipitare.
- Ce observi ?
S-a format un precipitat alb de fosfat de plumb.
Concluzia experimentului:
Acetatul de plumb precipită din soluțiile fosfaților, fosfatul de plumb, un precipitat alb-gălbui.
2 Na3PO4 (aq) + 3 (CH3COO)2Pb (aq) → 6 CH3COONa (aq) + Pb3(PO4)2 ↓ (pp. alb)