VI.3.2. Identificarea și separarea anionilor din grupa a II a analitică.
Grupa a II-a analitică de anioni: Cl-, Br-, I-, S-2, SCN-, CN-, IO3- , BrO3-, [Fe(CN)6]4-, [Fe(CN)6]3-, ClO- etc.
Anionii grupei a II-a formează cu ionii Ag+ săruri care sunt insolubile în apă şi în soluţii diluate de acid azotic. Reactiv de grupă pentru anionii grupei a II-a este azotatul de argint în soluţie de acid azotic diluat (2 mol/l). Culorile caracteristice anionilor acestei grupe sunt : [Fe(CN)6]4- este crem, [Fe(CN)6]3- este roşu-portocaliu, iar ceilalţi ioni sunt incolori.
👀 Experiment: Identificarea anionului clorură (Cl-) cu azotatul de argint
🔥 Atenție! Azotatul de argint și acidul clorhidric sunt caustici și îți pot produce arsuri în contact cu pielea !
Materiale necesare:
Sticlă de ceas sau eprubetă, acid clorhidric, soluție de azotat de argint (piatra iadului), pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de acid clorhidric și adaugă apoi puțină soluție de azotat de argint.
- Ce observi ?
S-a format un precipitat alb brânzos de clorură de argint.
Concluzia experimentului:
Acidul clorhidric (HCl) reacționează cu azotatul de argint (AgNO3) și se transformă în clorură de argint AgCl și acid azotic. Clorura de argint este un precipitat alb brânzos, care este insolubilă în apă, la încălzire.
Ag+ + Cl- → AgCl ↓
AgNO3 + HCl = AgCl ↓ + HNO3
Această reacție permite atât identificarea cationului de Ag+, cât și anionului clorură, Cl- din acidul clorhidric și sărurile lui (cloruri).
Clorura de argint este insolubilă în acizi, dar solubilă în soluţii de NH4OH şi de (NH4)2CO3:
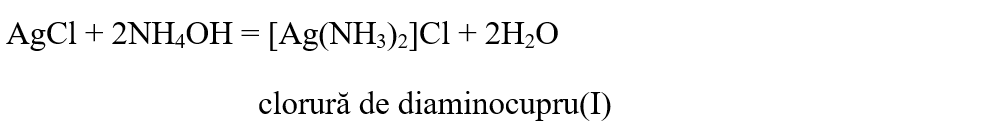
👀 Experiment: Identificarea anionului bromură (Br-) cu azotatul de argint
🔥 Atenție! Azotatul de argint este caustic și îți poate produce arsuri în contact cu pielea!
Materiale necesare:
Sticlă de ceas sau eprubetă, bromură de potasiu, soluție de azotat de argint, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de KBr și adaugă soluție de azotat de argint până la precipitare.
- Ce observi ?
S-a format un precipitat galben pal de bromură de argint.
Concluzia experimentului:
Identificarea anionului bromură, Br-, cu azotatul de argint are loc cu precipitare AgBr (pp. galben pal), după următoarea reacție :
Ag+ + Br– = AgBr↓
AgNO3(aq) + KBr (aq) → KNO3 (aq) + AgBr ↓
Bromura de argint este fotosensibilă și cea mai utilizată dintre toate halogenurile de argint în domeniul filmului fotografic. AgBr se aplică pe respectivele filme, realizate cu acetat de celuloză, suspendate într-o gelatină (emulsie fotografică) și în prezența 4- (metilamino) fenol sulfat (Metol) sau fenidonă și hidrochinonă.
👀 Experiment: Identificarea anionului bromură (Br-) cu acetat de plumb
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
Materiale necesare:
Eprubetă, soluție de bromură de potasiu, soluție de acetat de plumb, pipetă.
Descrierea experimentului:
- Pune în eprubetă câteva picături de soluție de KBr și adaugă soluție de Pb(COOCH3)2 până la precipitare.
- Ce observi ?
S-a format un precipitat alb de bromură de plumb.
Concluzia experimentului:
Acetatul de plumb precipită din soluțiile bromurilor, bromura de plumb, un precipitat alb.
2 KBr (aq) + (CH3COO)2Pb (aq) → 2 CH3COOK (aq) + PbBr2 ↓
👀 Experiment: Identificarea anionului iodură (I-) cu azotatul de argint
🔥 Atenție! Azotatul de argint este caustic și îți poate produce arsuri în contact cu pielea !
Materiale necesare:
Sticlă de ceas sau eprubetă, iodură de potasiu, soluție de azotat de argint (piatra iadului), pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de KI și adaugă soluție de azotat de argint până la precipitare.
- Ce observi ?
S-a format un precipitat galben-verzui de iodură de argint.
Concluzia experimentului:
Identificarea anionului iodură, I-, cu azotatul de argint are loc cu precipitare AgI (pp. galben-verzui), după următoarea reacție:
Ag+ + I– = AgI↓
AgNO3(aq) + KI (aq) → KNO3(aq) + AgI↓
Iodura de argint este fotosensibilă și se descompune la lumină colorându-se în verde. Ea este insolubilă în acizi şi în soluţie de NH4OH. Iodura de argint se dizolvă în soluţie de tiosulfat de sodiu cu formarea unui compus complex:

👀 Experiment: Identificarea anionului iodură (I-) cu acetat de plumb
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
Materiale necesare:
Eprubetă, soluție de iodură de potasiu, soluție de acetat de plumb, pipetă.
Descrierea experimentului:
- Pune în eprubetă câteva picături de soluție de KI și adaugă soluție de Pb(COOCH3)2 până la precipitare.
- Ce observi ?
S-a format un precipitat galben de iodură de plumb.
Concluzia experimentului:
Acetatul de plumb precipită din soluțiile iodurilor, iodura de plumb, un precipitat galben.
2 KI (aq) + Pb(COOCH3)2 (aq) → PbI2 ↓ + 2 CH3COOK (aq)
Precipitatul de iodură de plumb este solubil în exces de reactiv.
👀 Experiment: Identificare anionului sulfură cu acid clorhidric
🔥 Atenție! Experimentul se efectuează numai de către profesor și sub nișă sau în aer liber!
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
🔥 Atenție! Acidul sulfhidric este extrem de toxic și iritant! Provoacă arsuri grave ale căilor respiratorii, ochilor și pielii! Concentrațiile mari pot cauza pierderea conștienței și decesul imediat.
Materiale necesare:
Eprubetă, sulfură de fier, acid clorhidric, pipetă, clește de lemn, soluție de acetat de plumb, hârtie de filtru.
Descrierea experimentului:
- Pune în eprubetă sulfură de fier și câteva picături de HCl.
- Ce observi ?
Se degajă un gaz incolor cu miros de ouă clocite.
Concluzia experimentului:
Anionul sulfură în reacție cu un acid se recunoaște după degajarea acidului sulfhidric, un gaz incolor cu miros de ouă clocite.
FeS (s) + 2 HCl (aq) → FeCl2 (aq) + H2S ↓
Anionul sulfură este anionul acidului sulfhidric, care reprezintă o soluție apoasă a gazului incolor H2S, cu miros de ouă alterate, foarte toxic. Acidul sulfhidric este acid bibazic foarte slab și reducător puternic. Majoritatea sărurilor lui sunt greu solubile în apă, cu excepția sulfurile metalelor alcaline, alcalino-pământoase și cea de amoniu.
Degajarea acidului sulfhidric se recunoaște după înnegrirea hârtiei de filtru îmbibată cu soluție de acetat de plumb:
H2S (g) + (CH3COO)2Pb (aq) → 2 CH3COOH (aq) + PbS ↓