IV.3. Reacția de descompunere electrolitică
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Acidul sulfuric este caustic !
🔥 Atenție! Când lucrezi cu surse de foc !
Materiale necesare:
2 eprubete, apă, electrolizor, chibrit, acid sulfuric diluat, baterie, mănuși chirurgicale, așchie de brad.
Descrierea experimentului:
- Pune în electrolizor (vas de electroliză cu doi electrozi de grafit) apă și adaugă puțin acid sulfuric, pentru a o face conductoare (apa pură este izolatoare).
- Umple cele două eprubete tot cu apă acidulată, ca în electrolizor și pune-le pe fiecare electrod, astfel încât să nu se verse apa din ele.
- Leagă cei doi electrozi la o baterie și așteaptă până când în eprubete apa este înlocuită de două gaze.
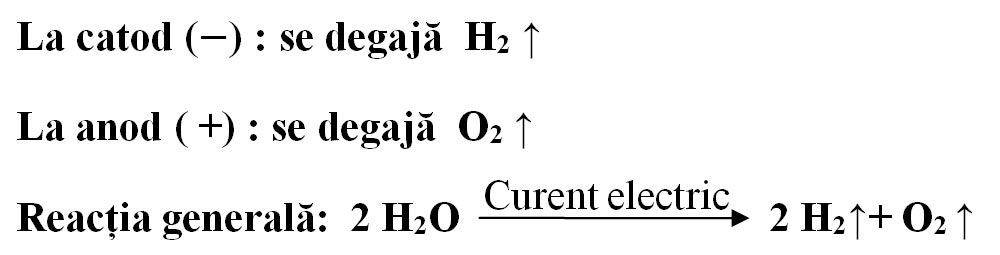
- Vino cu o așchie de brad care are câteva puncte incandescente deasupra eprubetei de la anod (electrodul pozitiv, legat la borna plus a bateriei). Ce observi ?
- Vino cu un chibrit aprins deasupra eprubetei de la catod (electrodul negativ, legat la borna minus a bateriei).
- Ce observi ?
La anod s-a degajat oxigen, care aprinde așchia de brad cu puncte incandescente, iar la catod s-a degajat hidrogen, care arde în prezența oxigenului din aer cu o pocnitură.
Concluzia experimentului:
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Clorura de cupru II este nocivă prin inhalare sau ingerare, iritantă pentru ochi, piele și căile respiratorii. Este periculoasă pentru mediu!
🔥 Atenție! Clorul este extrem de toxic și extrem de iritant pentru căile respiratorii, piele și ochi. Este oxidant ! Mortal în caz de inhalare! Foarte toxic pentru mediul acvatic cu efecte pe termen lung.
Materiale necesare:
Sursă de alimentare (baterie electrică de 9V sau alimentator), electrozi de grafit (mine mai groase de creion mecanic), suport electrozi confecţionat din carton , conductoare de legătură, apă distilată, clorură de cupru II, linguriţă şi pahar.
Descrierea experimentului:
- Dizolvă 1-2 lingurițe de clorură de cupru II în apă distilată, cât să umple paharul.
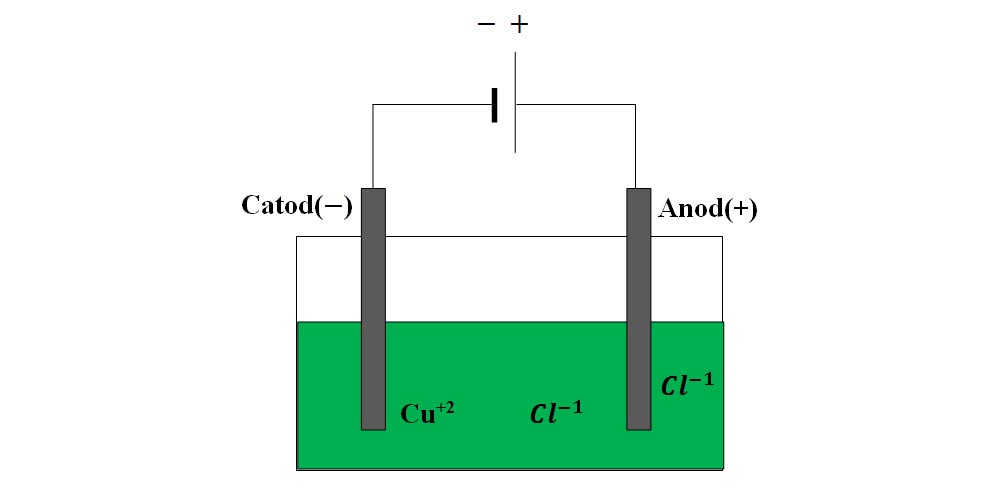
- Fixează electrozii de grafit în suport şi aşază suportul pe pahar.
- Leagă un electrod la o bornă a bateriei și pe cel de-al doilea la cealaltă bornă a bateriei.
- Introdu electrozii legați la baterie în soluția de clorură de cupru II.
- Ce observi ?
La trecerea curentului electric printr-o soluție de clorură de cupru II, la anod se degajă un gaz galben-verzui, extrem de sufocant și pe catod se depune un metal roșu-arămiu.
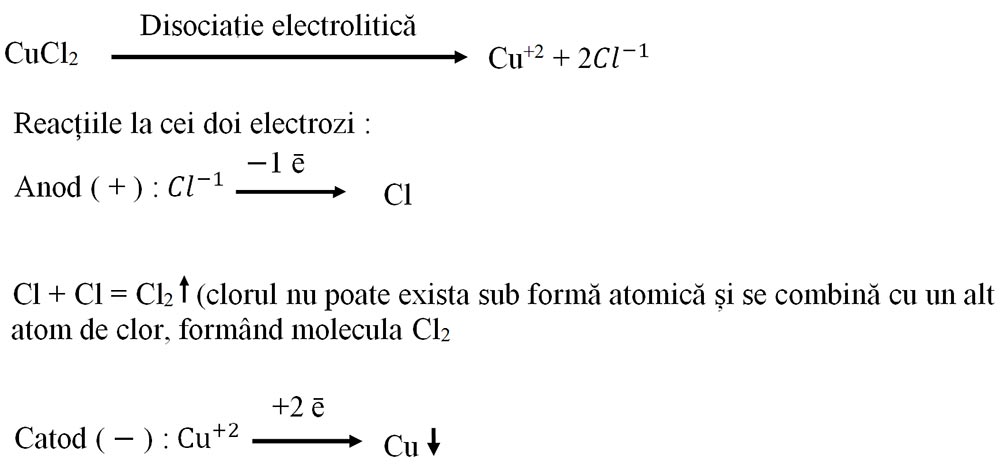
Concluzia experimentului:
Soluția de clorură de cupru II, prin electroliză, se descompune în clor (Cl2) şi cupru (Cu).
CuCl2 → Cu ↓ + Cl2 ↑