IX.4.4. Pile galvanice din legume sau fructe
Vom începe cunoașterea câtorva pile electrochimice cu elementul Volta (pilă galvanică), care are o importanţă mai mult istorică, fiind prima sursă de curent electric descoperită de oameni.
De fapt, descoperirea unui fenomen electric nou – curentul electric – a fost posibilă datorită unei întâmplări petrecută în 1786, la Bologna, de către medicul italian Luigi Galvani (1737-1798). El a observat că picioarele de broaște proaspăt disecate, prezintă contracții la atingerea cu două metale diferite, de exemplu două sârme, una din fier şi alta din cupru, legate între ele. De la aceste experimente, Galvani a ajuns la concluzia că există o anumită electricitate animală, publicându-şi experienţele într-un volum, în 1791.
Citind volumul lui Galvani, un alt fizician italian, Alessandro Volta (1745-1827) a ajuns în urma multor experienţe efectuate tot pe broaște, la concluzia că nu este vorba de vreo electricitate animală, ci de producerea de curent electric ce apare între cele două metale diferite, aplicate pe mușchii picioarelor de broască ce conțineau ser fiziologic şi alte substanţe conductoare electric.
De aici până la născocirea pilei electrice pe care a realizat-o ulterior, numită şi “pila lui Volta”, nu a mai fost decât un pas.
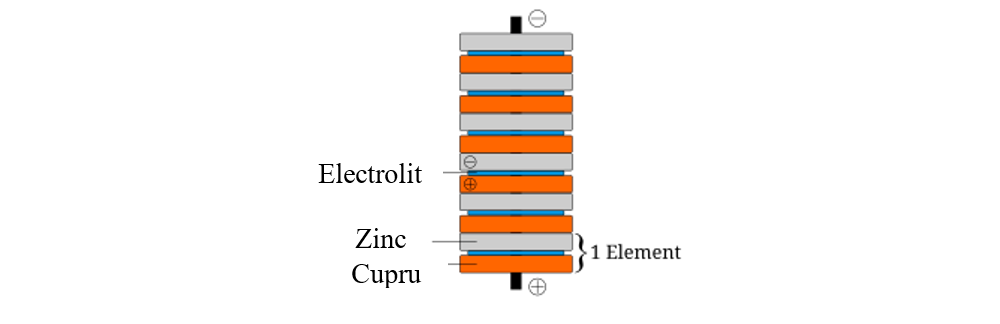
Astfel, în 1800, Volta a construit a baterie de pile electrice alcătuită din discuri de Zn şi Cu, între care a așezat discuri de postav îmbibate cu apă acidulată.

Materiale necesare:
Lămâi, monede de 5 bani, agrafe de birou, fire de legătură, un voltmetru.
Descrierea experimentului:
- Introdu într-o lămâie într-o parte o monedă și în cealaltă parte agrafa de birou.
- Prinde câte un fir de legătură de monedă, respectiv de agrafă și conectează-le la un voltmetru în paralel. Notează tensiunea electromotoare a acesteia.
- Grupează în serie cu prima lămâie o altă lămâie, legând moneda uneia de agrafa celeilalte și leagă capetele acestei grupări la voltmetru în paralel. Notează tensiunea electromotoare a acestei grupări.
- Ce observi ?
Crește tensiunea electromotoare a grupării de lămâi.
- Dacă mai dispui de lămâi poți continua cu o grupare mai mare de baterii din lămâi.
Concluzia experimentului:
Bateriile din lămâi generează curent electric ca și celelalte baterii, prin transformarea energiei chimice a reacțiilor care au loc între cele două metale diferite și sucul de lămâie în energie electrică.
Prin legarea mai multor baterii în serie crește tensiunea electromotoare a grupării respective.
Materiale necesare:
4 mere (lămâi, roșii, cartofi), 4 plăcuțe de cupru, 4 plăcuțe de zinc (agrafe de birou), 5 fire de legătură și un led de putere mică.
Descrierea experimentului:
- Introdu în primul măr o plăcuță de cupru și în al doilea măr o plăcuță de zinc și apoi leagă cele două plăcuțe cu un fir.
- Înfige o plăcuță de cupru în al doilea măr și o altă plăcuță de zinc în cel de-al treilea măr și apoi leagă cele două plăcuțe cu un fir.
- Înfige o plăcuță de cupru în al treilea măr și o altă plăcuță de zinc în cel de-al patrulea măr și apoi leagă cele două plăcuțe cu un fir.
- Înfige o plăcuță de cupru în al patrulea măr, leagă plăcuța cu un fir de un led și înfige a patra plăcuță de zinc în primul măr și conecteaz-o cu un fir de led.
- Bateria astfel obținută este formată din cele patru mere legate în serie.
- Ce observi ?
Ledul se aprinde.
Concluzia experimentului:
Funcționarea bateriei din mere
Între cele două metale cu caracter electropozitiv diferit au loc reacții chimice (redox) prin intermediul electrolitului (sucul de măr).
Curentul electric generat de această baterie este produs prin transformarea energiei chimice în energie electrică. Mai multe mere conectate în serie pot aprinde un LED de putere mică.
La anodul de zinc (polul negativ al pilei galvanice) are loc reacția de oxidare (cu cedare de electroni), acesta având un caracter electropozitiv mai accentuat decât cuprul.
La catodul de cupru (polul pozitiv al pilei galvanice) are loc reacția de reducere (cu acceptare de electroni). Astfel, apare un flux de electroni printr-un proces de difuzie a electronilor între cele două metale, care produce un curent electric într-un circuit extern format din led și conductoare de legătură.
Prin convenție, anodul este considerat electrodul unde are loc reacția de oxidare (cedare de electroni)
La electroliză, într-o celulă electrolitică anodul are polaritate pozitivă deoarece el atrage ionii negativi, care vor ceda electroni pentru a se neutraliza.
În celulele voltaice (galvanice), anodul este polul negativ deoarece acolo are loc reacția de oxidare (cu cedare de electroni). De exemplu, zincul cedează electroni care se acumulează pe electrod, electroni care vor fi trimiși prin circuitul exterior către catod (cupru).
Această baterie reproduce fenomenele care au avut loc în prima baterie electrică inventată de Alessandro Volta, în 1799. Pila lui Volta folosea tot plăcuțe de zinc și cupru, cu deosebirea electrolitului, din soluție de sare.