VI.2.1.3. Identificarea cationului de plumb
👀 Experiment: Identificarea cationului de plumb (Pb2+) cu hidroxidul de sodiu
🔥 Atenție! Hidroxidul de sodiu este caustic!
🔥 Atenție! Sărurile de plumb sunt toxice și periculoase pentru mediu!
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de acetat de plumb, soluție de hidroxidul de sodiu, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de (CH3COO)2Pb și adaugă soluție de NaOH până la precipitare.
- Ce observi ?
S-a format un precipitat alb de hidroxid de plumb.
- Adaugă peste precipitatul format NaOH până la dizolvarea completă a precipitatului.
Concluzia experimentului:
Hidroxidul de sodiu precipită din soluțiile sărurilor de plumb, hidroxidul de plumb de culoare albă, care este solubil în exces de reactiv, cu formarea unei combinații complexe de tetrahidroxoplumbat de sodiu:
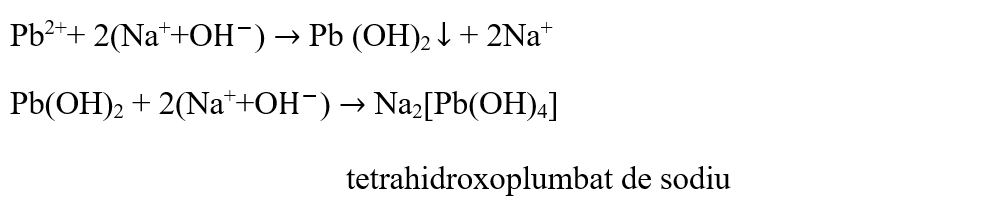
👀 Experiment: Identificarea cationului de plumb (Pb2+) cu iodură de potasiu
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
🔥 Atenție! Acidul clorhidric și soda caustică sunt caustice!
Materiale necesare:
2 pahare Berzelius, 1 pahar Erlenmeyer, acetat de plumb, iodură de potasiu, apă distilată, spirtieră, trepied cu sită de azbest, pâlnie, hârtie de filtru.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de (CH3COO)2Pb și adaugă soluție de KI până la precipitare.
- Ce observi ?
S-a format un precipitat galben-portocaliu.
Acetatul de plumb, (CH3COO)2Pb, reacționează cu iodura de potasiu, KI, cu formarea acetatului de potasiu, CH3COOK, și iodurii de plumb, PbI2 (precipitat galben-portocaliu)
(CH3COO)2Pb + 2 KI → CH3COOK + PbI2 ↓
- Iodura de plumb este solubilă în iodura de potasiu luată în cantități excesive, cu formarea complexului de tetraiodoplumbat de potasiu:

- Iodura de plumb este solubilă și în acid clorhidric, cu formarea complexului de acid tetracloroplumbat II :

- Iodura de plumb este solubilă și în hidroxid de sodiu, cu formarea complexului de tetracloroplumbat de sodiu :

👀 Experiment: Identificarea cationului de plumb (Pb2+) cu cromat de potasiu
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
🔥 Atenție! Cromatul de potasiu este o substanță foarte toxică, corozivă și periculoasă pentru mediu!
Materiale necesare:
Eprubetă, soluție de acetat de plumb, soluție de cromat de potasiu, spatulă, pipetă.
Descrierea experimentului:
- Pune în eprubetă soluția de acetat de plumb și adaugă cu pipeta soluție de cromat de potasiu.
- Ce observi ?
S-a format un precipitat galben de cromat de plumb.
Concluzia experimentului:
Cromatul de potasiu precipită din soluțiile sărurilor de plumb cromatul de plumb, de culoare galbenă:
Pb2+ + (2K+ + CrO4-2) → PbCrO4 ↓ + 2K+
Pb(CH3COO)2 + K2CrO4 → PbCrO4 ↓ + 2 KCH3COO
Acetat de plumb + cromat de potasiu → cromat de plumb + acetat de potasiu