V.3.1. Formarea moleculelor
Atomii cu același caracter chimic (nemetalele) pot ajunge la configurația stabilă de dublet sau octet punând în comun electronii de valență și formând molecule.
În molecule legătura obținută prin punerea în comun de electroni se numește legătură covalentă.
Molecula reprezintă cea mai mică particulă dintr-o substanță, care poate exista și în stare liberă și care păstrează proprietățile substanței din care provine.
Caracteristicile moleculelor:
-
Particule stabile
-
Particule electric neutre
-
Au forme și dimensiuni diferite
-
Între molecule există spații intermoleculare
-
Moleculele se mișcă dezordonat în funcție de temperatură
-
Moleculele aceleiași substanțe sunt identice
-
Reprezintă grupări de atomi identici sau diferiți.
I. După felul atomilor care participă la formarea legăturii, avem:
1. Legătură covalentă nepolară prin punerea în comun de electroni între atomi identici. Se formează substanțe simple moleculare (H2, N2, O2, F2, Cl2, Br2, I2)
Exemple:
a) formarea moleculei de hidrogen (H2):

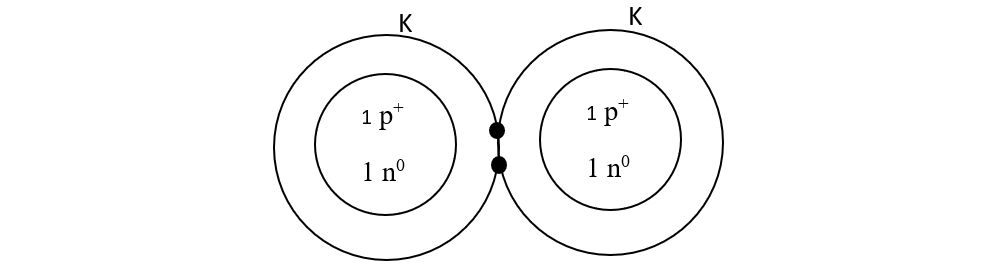
b) formarea moleculei de clor (Cl2) :
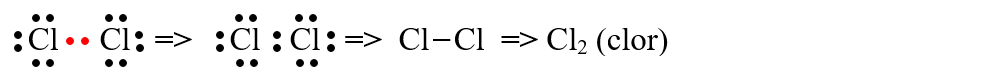
În mod identic se formează și moleculele de F2 (fluor), I2 (iod) și Br2 (brom).
c) formarea moleculei de oxigen (O2) - Nu este în programa de Clasa a VII-a:
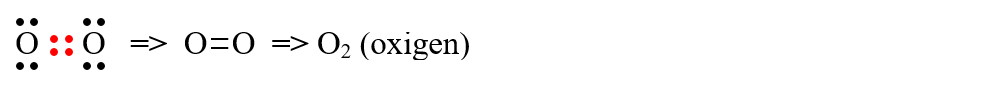
d) formarea moleculei de azot (N2) - Nu este în programa de Clasa a VII-a:

2. Legătură covalentă polară prin punerea în comun de electroni între atomi diferiți. Se formează substanțe compuse moleculare (compuși moleculari).
Exemple:
a) formarea moleculei de acid clorhidric (HCl)
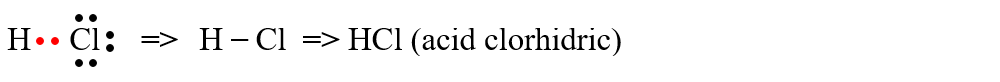
b) formarea moleculei de apă (H2O)
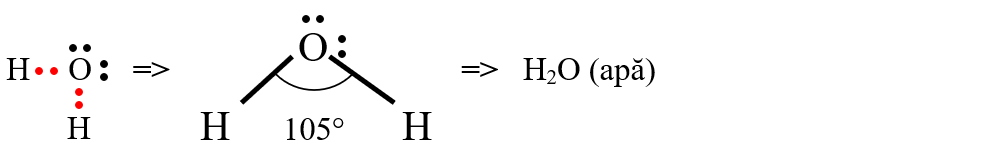
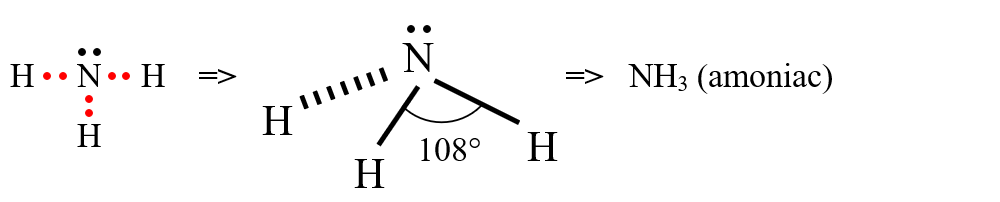
c) formarea moleculei de amoniac (NH3)
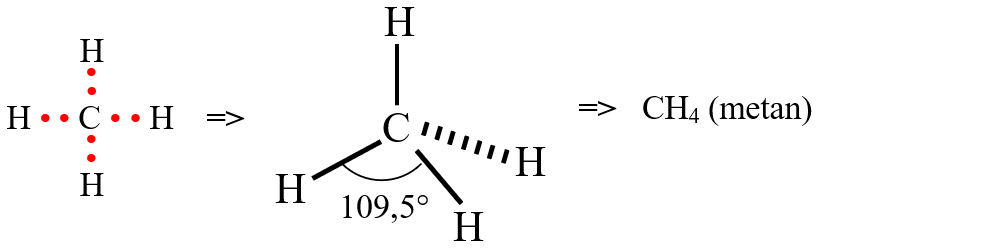
d) formarea moleculei de metan (CH4)
II.După numărul perechilor de ē puse în comun avem:

Formula chimică reprezintă notarea moleculei cu ajutorul simbolurilor chimice ale elementelor componente și al indicelor, pentru a arăta numărul atomilor din fiecare element.
Indicele 1 nu se trece.
Molecula fiind formată din atomi, are dimensiuni foarte mici și masă foarte mică.
Masa moleculară este o mărime adimensională (un număr) care ne arată de câte ori este mai mare masa reală a unei molecule decât unitatea atomică de masă (u.a.m.).
Ea se calculează însumând masele atomice relative ale tuturor atomilor moleculei.
Exemplu:
Masa moleculară a apei (H2O) este MH2O= 2 AH +1 AO = 2 + 16 = 18