II.2.1. Metode de separare a amestecurilor omogene
II.2.1.1. Cristalizarea
Cristalizarea este metoda de separare a unei substanțe solide sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea substanței lichide.
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
Materiale necesare:
Pahar Berzelius, apă, cristale de piatră vânătă, baghetă, sită de azbest, spirtieră, chibrit, capsulă, trepied.
Descrierea experimentului:
- În pahar amestecă apa cu piatra vânătă cu ajutorul baghetei.
- Pune amestecul format într-o capsulă pe care o așezi pe sita de azbest de pe trepied și încălzește-l la flacăra spirtierei.
- Ce observi ?
Apa se evaporă și se obțin în capsulă cristale de piatră vânătă.
Concluzia experimentului: Prin cristalizare am separat o substanță solidă sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea apei.
🔥 Atenție! Acest experiment se efectuează numai în prezența unui adult!
🔥 Atenție! Când lucrezi cu surse de foc ai grijă să ai părul strâns și să nu porți haine cu mâneci largi!
🔥 Atenție! Când lucrezi cu apă caldă să nu te arzi!
🔥 Atenție! Piatra vânătă este toxică. Nu o atinge și nu o gusta!
🔥 Atenție! Acest experiment se efectuează numai în prezența unui adult!
🔥 Atenție! Când lucrezi cu surse de foc ai grijă să ai părul strâns și să nu porți haine cu mâneci largi!
🔥 Atenție! Când lucrezi cu apă caldă să nu te arzi!
🔥 Atenție! Piatra vânătă este toxică. Nu o atinge și nu o gusta!
- Extragerea sării din apa de mare.
- Extragerea zahărului din trestia/sfecla de zahăr.
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Acetatul de sodiu este un compus cu o toxicitate foarte scăzută. Este ușor iritant pentru ochi.
Căile respiratorii pot fi iritate după inhalare. Contactul frecvent și constant cu pielea poate provoca iritații.
Acetatul de sodiu și tiosulfatul de sodiu pot fi reutilizați în repetate rânduri. Respectați doar principiile de bază
ale manipulării reactivilor în laboratorul de chimie.
Materiale necesare:
4 pahare Berzelius foarte curate (preferabil ca acestea să fie noi - să nu fie zgâriate), acetat de sodiu, tiosulfat de
sodiu, spirtieră, stativ, sită de azbest, sticlă de ceas, termometru, dispozitiv Heat In a Click / Hot Pack sau
comprese calde, apă.
Descrierea experimentului:
- Ia un pahar Berzelius de preferat nou (ca să nu fie zgâriat) și foarte curat.
- Adaugă acetat de sodiu trihidrat (CH3-COONa x 3H2O).
- Încălzește acetatul de sodiu și adăugă puțină apă până când observi că s-a format o soluție limpede (aprox. 80-90°C). Dacă deasupra soluției, pe marginea interioară a paharului se formează un inel de cristale, toarnă întregul conținut al vasului într-un alt pahar curat.
- Acoperă paharul cu o sticlă de ceas și lăsă soluția să se răcească. Observă că soluția rămâne incoloră și limpede chiar și răcită la temperatura camerei.
- Adăugă un mic cristal de acetat de sodiu soluției respective și observă comportamentul acesteia.
Acetatul de sodiu cristalizează în masă, iar această cristalizare crește temperatura la 38-40°C.
Un alt reactiv cu un comportament similar acetatului de sodiu este tiosulfatul de sodiu.
- Ia un pahar Berzelius de preferat nou (ca să nu fie zgâriat) și foarte curat.
- Adăugă tiosulfat de sodiu pentahidratat (Na2S2O3 x 5H2O).
- Încălzește până când observi că s-a format o soluție limpede (aprox. 80-90°C). Sarea se dizolvă în propria apă de cristalizare generând o soluție limpede, saturată la 90°C.
- Acoperă paharul cu o sticlă de ceas și lăsă soluția să se răcească. Observă că soluția rămâne incoloră și limpede chiar și răcită la temperatura camerei. Măsoară temperatura soluției.
- Adăugă un mic cristal de tiosulfat de sodiu soluției respective și observă comportamentul acesteia. Măsoară din nou
temperatura.
Lăsată să se răcească soluția devine suprasaturată și cristalizează în masă dacă în aceasta se aruncă un singur cristal de tiosulfat de sodiu care să "însămânțeze soluția". Cristalizarea în masă a tiosulfatului de sodiu crește temperatura la 50°C.
Concluzia experimentului:
Creșterea temperaturii justifică folosirea acestei soluții în domeniul medical, dispozitivele respective purtând numele
de Heat In a Click / Hot Pack sau comprese calde. Soluții suprasaturate ale anumitor săruri pot fi folosite în practica
medicală pentru a genera căldură care să țină cald răniților până când aceștia ajung în siguranță la spital. Principiul
este simplu: o soluție suprasaturată când intră în contact cu cristalele proprii generează cristalizarea în masă a
întregii soluții procesul fiind exoterm, căldura degajată fiind folosită în practica medicală.
II.2.1.2. Distilarea
Distilarea constă în separarea componentelor lichide dintr-un amestec omogen, pe baza punctelor lor de fierbere diferite.
În timpul distilării au loc două fenomene fizice: vaporizarea, urmată de condensare.

Dacă în balon există un amestec de apă cu alcool, prin încălzire, temperatura va crește, iar când ajunge la 78 °C, alcoolul începe să fiarbă.
Pe toată durata fierberii alcoolului, temperatura rămâne constantă, la 78 °C. Vaporii de alcool ajunși în refrigerent sunt răciți și condensează.
Când temperatura începe să crească depășind 78 °C, alcoolul s-a separat de apă și se oprește distilarea. Apa s-a separat de alcool.
În general părțile componente ale amestecului au puncte de fierbere care nu diferă cu mai mult de 25 °C între ele, în condiții de presiune de o atmosferă. În schimb dacă diferența dintre punctele de fierbere este mai mare de 25 °C se poate folosi pentru separarea componenților o distilare simplă.
1. Obținerea apei distilate (pură din punct de vedere chimic), folosită în laboratoare, industrie, farmacie.

2. Obținerea băuturilor alcoolice în instalații industriale cu alambic.

3. Prin distilarea fracționată a petrolului, în rafinăriile petrochimice se obțin propan, butan, benzine, petrol lampant, motorină, păcură. Aceste produse ale distilării petrolului se folosesc drept combustibili, la obținerea maselor plastice, medicamentelor, cauciucului artificial, fibrelor artificiale, detergenți, insecticide, pesticide etc.

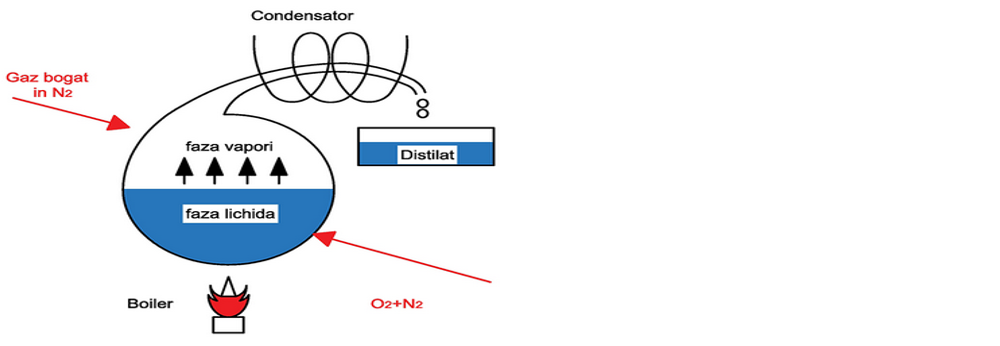
4. Distilarea fracționată a aerului cu separarea azotului de oxigen. Se consideră un balon de distilare care conține un amestec lichid de oxigen (componentul greu) și azot (componentul ușor). Dacă amestecul lichid este încălzit acesta va începe să fiarbă, producând vapori care conțin mai mult azot (componentul ușor) decât lichidul inițial. Acești vapori bogați în azot condensează într-un condensator.