IX.2. Stabilirea coeficienților în ecuațiile reacțiilor chimice.
Numărul de electroni schimbați între reducător și oxidant permite stabilirea coeficienților stoechiometrici pentru echilibrele cu schimb de electroni.
O reacție redox (de oxido-reducere) este reacția în care reactanții suferă schimbări în starea lor de oxidare.
Pentru stabilirea coeficienților stoechiometrici pentru echilibrele cu schimb de electroni se parcurg următoarele etape:
- Se scrie ecuația reacției redox fără coeficienți:
Cu + HNO3 → Cu(NO3)2 + H2O + NO↑
- Se stabilește N.O. pentru fiecare atom din fiecare compus ai reactanților și ai produșilor de reacție:
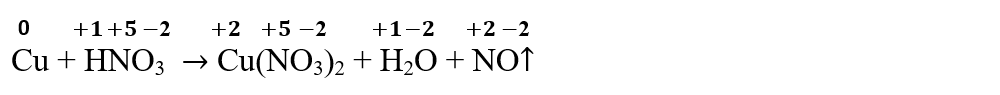
- Se identifică atomii care își schimbă N.O. și se scriu procesele parțiale de oxidare și de reducere care au loc:

- Se echilibrează cele două semireacții ținând cont că numărul de electroni cedați trebuie să fie egal cu numărul de electroni primiți. Pentru acest lucru trebuie să se găsească cel mai mic multiplu comun al numerelor de electroni transferați între cele două semireacții. În acest caz, cel mai mic multiplu comun este 6. Împărțim această valoare la numărul electronilor cedați (în procesul de oxidare), iar cu valoarea obținută înmulțim semireacția de oxidare. La fel se procedează şi cu semireacția de reducere.

- Se introduc coeficienții astfel obținuți în ecuația globală a reacției, se stabilesc coeficienții celorlalte specii chimice care iau parte la reacție, respectând bilanțul atomic:

3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 4 H2O + 2 NO↑
👀 Experiment: Identificarea anionului azotat (NO3-) cu cupru, în mediu acid
🔥 Atenție! Experiența se realizează numai de către profesor, cu echipament de protecție, sub nișă !
🔥 Atenție! Acidul sulfuric este caustic și îți poate produce arsuri în contact cu pielea!
🔥 Atenție! Dioxidul de azot obținut este un gaz toxic, coroziv și extrem de iritant !
Materiale necesare:
Eprubetă, azotat de sodiu, acid sulfuric concentrat, granulă de cupru, pipetă, spirtieră, clește de lemn.
Descrierea experimentului:
- Pune într-o eprubetă 5 picături de soluţie de azotat de sodiu, adaugă 5 picături de H2SO4 concentrat şi o granulă de cupru metalic.
- Încălzește amestecul.
- Ce observi ?
La încălzirea amestecului se degajă un gaz brun de dioxid de azot (hipoazotită).
Concluzia experimentului:
Anionii azotat fac parte din grupa analitică a-III-a, alături de NO2-, CH3COO-, ClO3-, MnO4- etc. și care nu au reactiv de grupă. Practic toate sărurile acidului azotic sunt solubile în apă și de aceea ionul azotat nu se identifică prin reacţii de precipitare cu cationii.
În mediu acid, ionul azotat este un oxidant puternic. Majoritatea reacţiilor de identificare se bazează pe proprietăţile oxidante ale azotaţilor în mediu acid.
3Cu + 2NO3- + 8H+ → 3Cu2+ + 4H2O + 2NO ↑
Monoxidul de azot obţinut se oxidează cu oxigenul din aer până la dioxid de azot (NO2), de culoare brună :
2NO + O2 = 2NO2 ↑