IX.4.1. Pila Daniell
Pilele electrochimice, numite şi pile galvanice, sunt sisteme în care energia chimică este convertită în energie electrică.
Conversia electrochimică de energie se poate realiza pe diferite căi. Sursele respective se pot clasifica în:
– pile primare, în care energia electrică se produce prin reacţii între reactanţii care se găsesc în pilă şi care nu se mai pot regenera printr-un proces de electroliză;
– pile secundare (acumulatoare) în care reactanții consumați în timpul producerii energiei se pot regenera printr-un proces de electroliza;
– pile de combustie, în care reactanții sunt alimentați continuu de electrozi.
Aplicațiile pilelor galvanice
- Baterii (acumulatori) pentru: telefoane, telecomenzi, mouse-uri, jucării, aparate de radio portabile, trotinete electrice etc.

- Baterii de maşini (acumulatoare cu plumb) care asigură pornirea mașinii.

- Pile de combustie (pentru autovehicule electrice, avioane, submarine şi rachete). De exemplu, autovehiculele electrice cu pile de combustie, care produc electricitate printr-o reacție între hidrogen și oxigen, au ca avantaje conducerea silențioasă, lină, performantă, puternică și fără emisii poluante.

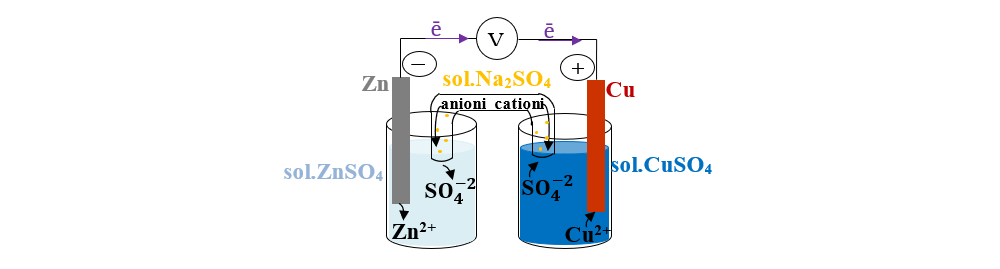
Pila Daniell este formată din două semicelule, care pot fi de exemplu, un electrod de zinc cufundat în soluția unei sări de Zn şi unul de cupru cufundat în soluția unei sări de Cu.
Electrodul pe care are loc un proces de oxidare se numeşte anod.
Electrodul pe care are loc un proces de reducere se numeşte catod.
👀 Experiment: Pila Daniell
🔥 Atenție! Sulfatul de zinc este toxic si periculos pentru mediu!
🔥 Atenție! Sulfatul de cupru este toxic si periculos pentru mediu!
Materiale necesare:
Două pahare Berzelius, soluții 1M de ZnSO4 și de CuSO4, soluție de NaCl, electrozi de Cu și de Zn, hârtie de filtru (vată), tub U, voltmetru, întrerupător, fire de legătură.
Descrierea experimentului:
- Realizează o semicelulă punând într-un pahar Berzelius o soluţie de concentraţie 1M de sulfat de zinc, ZnSO4, şi cufundă în soluţie o placă de zinc (electrod de zinc).
- Pentru a doua semicelulă a pilei pune în alt pahar Berzelius o soluţie de concentraţie 1M de sulfat de cupru, CuSO4, şi o placă de cupru (electrod de cupru).
- Umple un tub în formă de U cu soluţie saturată a unei sări (Na2SO4). Capetele tubului astupă-le cu dopuri de vată sau hârtie de filtru. Capetele tubului introdu-le în fiecare pahar. Acest tub se numeşte punte de sare și face legătura dintre soluţiile celor două semicelule.
- Conectează un voltmetru și un întrerupător între cei doi electrozi de cupru şi de zinc.
- Închide circuitul electric cu ajutorul întrerupătorului şi observă acul indicator al voltmetrului.
- Ce indică acesta ?
Acul voltmetrului deviază slab într-o parte a scalei gradate față de diviziunea 0.
Principiul de funcționare al pilei Daniell
Atomii de zinc se oxidează mai uşor (cedează electroni mai ușor) decât atomii de cupru şi trec în soluţie ca ioni de Zn2+. Electronii cedaţi se acumulează pe placa de zinc, de unde migrează, prin firul conductor, pe placa de cupru.
Ionii de Cu2+ au tendinţa de a se reduce (de a accepta electroni) mai accentuată decât ionii Zn2+. De aceea, electronii de pe electrodul de Cu vor fi acceptaţi de ionii Cu2+, care trec în atomii de cupru şi se depun pe placa de cupru.
Electronii cedaţi de zinc trec prin circuitul exterior spre electrodul de cupru, de unde sunt preluaţi în procesul de reducere a ionilor Cu2+. Astfel, în circuitul exterior se generează un curent electric continuu.
Deci, funcţionarea pilei se bazează pe diferenţa de caracter electropozitiv a celor două metale.
În semicelula zincului (element mai electropozitiv) are loc procesul de oxidare. Electrodul de zinc reprezintă anodul şi borna negativă a pilei. Deci, electrodul de zinc este anodul elementului galvanic, iar polaritatea sa va fi negativă întrucât, în urma desfăşurării reacţiei de electrod, metalul rămâne cu un exces de electroni.
În semicelula cuprului (element mai slab electropozitiv) are loc procesul de reducere. Electrodul de cupru reprezintă catodul şi borna pozitivă a pilei.
Construită în felul acesta, pila va funcţiona o fracţiune de secundă.
În urma procesului de oxidare, soluţia din jurul zincului metalic nu mai este neutră. În soluţie vor fi mai mulţi ioni Zn2+, decât ioni SO42-, situaţie care împiedică trecerea a noi ioni Zn2+ în soluţie şi blochează funcţionarea pilei. În semicelula cuprului, în soluţie vor exista mai puţini ioni Cu2+ decât ioni SO42-, situaţie care blochează procesul de reducere a noi ioni Cu2+.
Pentru neutralizarea soluțiilor din cele două semicelule se introduce puntea de sare (soluție saturată a unei sări: Na2SO4) care face legătura între cele două soluții. Ionii negativi (anionii) din puntea de sare trec spre semicelula anodului, iar ionii pozitivi (cationii) din puntea de sare trec spre semicelula catodului.
Diafragma nu permite amestecarea celor două soluţii, dar permite trecerea ionilor de SO42- în timpul funcţionării pilei.

Reacția totală redox care are loc în pila Daniell este:
Zn + Cu2+ → Zn2+ + Cu ↓
Pila Daniell se reprezintă convențional astfel:
(-) Zn | Zn2+ || Cu2+ | Cu (+)
🔦 Observație
Polul negativ, anodul, se scrie în stânga (Zn/Zn2+), iar polul pozitiv, catodul, se scrie în dreapta (Cu2+/Cu).
Linia verticală reprezintă suprafața care desparte conductorul metalic de soluția în care se află, iar cele două linii verticale reprezintă diafragma care separă electrozii.