V.2. Reacția metalelor cu apa
1. Metalele alcaline (grupa 1) și alcalino-pământoase (grupa 2) reacționează cu apa cu formare de baze și hidrogen.
Me + n H2O → Me(OH)n + n/2 H2 ↑
Exemplu :
2 Na + 2 H2O → 2 NaOH + H2 ↑
2. Aluminiul nu reacționează cu apa deoarece este acoperit cu un strat protector de oxid de aluminiu. Prin amalgamare cu mercur (în prezența sărurilor de mercur) și prin încălzire, aluminiul poate reacționa cu apa cu formare de hidroxid de aluminiu și hidrogen.
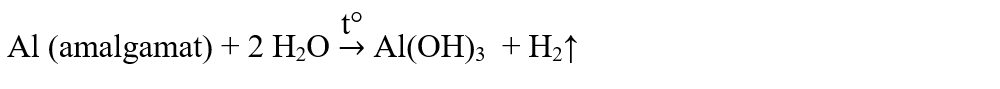
3. Metalele tranziționale aflate înaintea hidrogenului în seria activității chimice a metalelor, în reacție cu apa, prin încălzire, formează oxizi metalici și hidrogen.
Zn + 2 H2O → ZnO + H2 ↑
3 Fe + 4 H2O → Fe3O4 + H2 ↑
4. Metalele aflate după hidrogen în seria activității chimice a metalelor nu reacționează cu apa.
Unele metale se corodează în prezența aerului umed, într-un timp mai îndelungat.
a) Fierul, în prezența aerului umed, formează rugină, care este un amestec de oxizi de fier (III) hidratați -Fe2O3·nH₂O) și hidroxizi de fier III - FeO(OH), Fe(OH)3, un compus poros de culoare maronie. Rugina se exfoliază continuu, expunând întregul obiect de fier procesului de coroziune.

b) Cuprul, în prezența aerului umed (cu dioxid de carbon, apă și oxigen), formează cocleală, care este un carbonat bazic de cupru -CuCO3•Cu(OH)2, un compus de culoare verde și toxic.

🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Sodiul se poate aprinde în aer! Se formează hidroxid de sodiu extrem de caustic! Se formează hidrogen
care poate exploda în oxigenul din aer!
🔥 Atenție! Când lucrezi cu surse de foc !
Materiale necesare:
Cristalizor, apă, sodiu, fenolftaleină, clește metalic, pâlnie, chibrit.
Descrierea experimentului:
- Pune în cristalizor puțină apă și adaugă câteva picături de fenolftaleină.
- Cu multă grijă taie o bucățică mică de sodiu sub petrol (metalele alcaline, fiind foarte reactive, se păstrează sub petrol).
- Cu un clește pune bucățica de sodiu în apa din cristalizor și acoperă cu pâlnia. Vino cu un băț de chibrit aprins deasupra pâlniei.
- Ce observi ?
Sodiul reacționează energic cu apa, înroșind fenolftaleina și când apropiem flacăra chibritului de pâlnie, are loc o pocnitură explozivă.
Concluzia experimentului:
Sodiul reacționează la rece și extrem de violent cu apa, cu formare de hidroxid de sodiu – NaOH (a înroșit
fenolftaleina) și hidrogen – H2 (arde cu explozie în aer). Este o reacție de substituție, deoarece avem
ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2 Na + 2 H2O = 2 NaOH + H2 ↑
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Când lucrezi cu surse de foc !
Materiale necesare:
Eprubetă, apă, pulbere de magneziu, fenolftaleină, clește de lemn, chibrit, spirtieră, spatulă.
Descrierea experimentului:
- Pune în eprubetă puțină apă și adaugă câteva picături de fenolftaleină.
- Cu spatula pune puțină pulbere de magneziu în apă.
- Cu un clește de lemn ține eprubeta în flacăra spirtierei, rotind-o continuu.
- Vino cu un băț de chibrit aprins deasupra eprubetei.
- Ce observi ?
Magneziul reacționează la cald cu apa, înroșind fenolftaleina și gazul rezultat arde în aer.
Concluzia experimentului:
Magneziul reacționează la cald cu apa, cu formare de hidroxid de magneziu – Mg(OH)2 (a înroșit
fenolftaleina) și hidrogen – H2 (arde cu flacără în aer). Este o reacție de substituție, deoarece avem
ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Mg + 2 H2O = Mg(OH)2 + H2 ↑
🔥 Atenție când lucrezi cu surse de foc !
🔥 Atenție! Clorura de mercur este toxică!
Materiale necesare: Folie de aluminiu, 2 eprubete, stativ pentru eprubete, apă distilată, soluție de clorură de mercur, fenolftaleină, clește de lemn, chibrit, sursă de foc (aragaz sau spirtieră).
Descrierea experimentului:
- Pune în eprubetă puțină apă, adaugă câteva picături de fenolftaleină și apoi introdu folia de aluminiu și las-o în eprubetă timp de 2 minute.
- Ce observi?
La temperatura camerei, aluminiul nu reacționează cu apa.
- Cu un clește de lemn ține apoi eprubeta în sursa de foc (flacăra aragazului sau a spirtierei), rotind-o continuu.
- Vino cu un băț de chibrit aprins deasupra eprubetei.
- Ce observi ?
Aluminiul nu reacționează cu apa, nici la rece, nici la cald (nu s-a putut detecta prezența hidrogenului).
- În continuare, în a doua eprubetă pune 5 ml clorură de mercur și apoi introdu folia de aluminiu.
- Pune eprubeta într-un stativ și așteaptă până când aluminiul se acoperă cu un strat de mercur (reacția este destul de lentă).
- Ce observi ?
Aluminiu formează la rece cu mercurul un aliaj, numit amalgam de aluminiu.
2 Al + 3 HgCl2 → 3 Hg ↓ + 2 AlCl3
Al + Hg → Al-Hg (amalgam de aluminiu)
- Scoate folia de aluminiu amalgamat și introdu-o în eprubeta ce conține ap�ă distilată și fenolftaleină.
- Cu cleștele de lemn ține apoi eprubeta cu apa distilată și folia de aluminiu amalgamat în sursa de foc (flacăra aragazului sau a spirtierei), rotind-o continuu.
- Vino cu chibrit deasupra eprubetei.
- Ce observi ?
Se observă cum se degajă hidrogen, care arde la gura eprubetei.
Ecuația reacției chimice :
2 Al (activat cu Hg) + 6 H2O → 2 Al(OH)3 + 3 H2↑
Concluzia experimentului:
Metalele foarte reactive (K, Ca, Na, Mg) și Al activat reacționează cu apa și formează hidroxizi și hidrogen, cele reactive (Zn, Fe, Sn, Pb) formează cu apa oxizi și hidrogen, iar cele mai puțin reactive (Cu, Hg, Ag, Au, Pt) nu reacționează cu apa.
Hidroxidul de aluminiu nu înroșește fenolftaleina, deoarece este o bază foarte slabă, având caracter amfoter, ceea ce înseamnă că nu generează suficientă bazicitate pentru a schimba culoarea indicatorului fenolftaleină în mediu apos.