IV.1. Reacția de descompunere
Știind că următoarele două reacții sunt reacții de descompunere, descoperă caracteristica lor comună:
CuCO3 → CuO + CO2 ↑
AgCl → Ag ↓ + Cl2 ↑
Observăm că avem un reactant și doi produși de reacție.
Reacția de descompunere este reacția în care avem un singur reactant și mai mulți produși de reacție.

-
Reactantul (A) este întotdeauna o substanță compusă.
-
Produșii reacției (B și C) pot fi atât substanțe simple, cât și substanțe compuse.
Tipuri de reacții de descompunere:
I. Reacția de descompunere termică (prin încălzire) a unor carbonați, hidroxizi, oxizi etc.
1. Prin descompunerea termică a unor carbonați neutri (de cupru, calciu, bariu, magneziu, fier, litiu) se obțin oxizi metalici și dioxid de carbon.

2. Prin descompunerea termică a unor carbonați acizi (de sodiu, de amoniu) se obțin fie carbonat neutru de sodiu, vapori de apă și dioxid de carbon, fie amoniac, vapori de apă și dioxid de carbon.
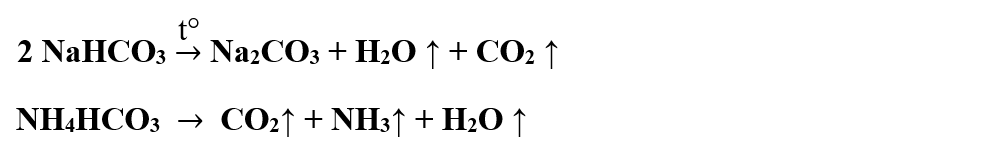
3. Prin descompunerea termică a unor hidroxizi greu solubili (de cupru, aluminiu, fier II, zinc) se obțin oxizi metalici și apă.

4. Descompunerea termică a unor oxizi metalici (de mercur, argint, cupru) are loc cu formarea metalului și oxigenului, sau a unui oxid inferior și oxigen (mai ales la oxizii metalelor mai reactive).

II. Reacția de descompunere electrolitică (cu ajutorul curentului electric).
1. Descompunerea apei cu ajutorul curentului electric are loc cu formarea hidrogenului și oxigenului:

III. Reacția de descompunere catalitică (cu ajutorul unui catalizator, care nu participă la reacție, doar mărește viteza reacției; el se regăsește în întregime în produșii de reacție).
1. Descompunerea apei oxigenate (H2O2) în prezența unui catalizator (dioxid de mangan, clorură de fier III etc.) are loc cu formarea apei și a oxigenului:

2. Descompunerea cloratului de potasiu (KClO3) în prezența unui catalizator (dioxid de mangan) și prin încălzire are loc cu formarea clorurii de potasiu și a oxigenului :

IV. Reacția de descompunere la lumină a halogenurilor de argint.
1. Halogenurile de argint sunt fotosensibile.Ele se descompun în prezența luminii în elemenele componente. Bromura de argint (AgBr) se descompune în argint și brom.

Reacția de descompunere este importantă, întrucât se obțin substanțe chimice cu multe utilizări:
-
var nestins – CaO;
-
oxigen – O2;
-
hidrogen – H2;
-
clor – Cl2;
-
mercur - Hg;
-
unele metale – Al
-
anumiți oxizi metalici etc.
Anumiți carbonați acizi (bicarbonat de sodiu, bicarbonat de amoniu) se folosesc în patiserii și cofetării pentru a crește aluatul în timpul coacerii, deoarece prin descompunerea lor termică se obține un volum mare de gaze, care fac aluatul pufos.
Descompunerea hidroxizilor greu solubili duce la formarea unor oxizi metalici, cu numeroase utilizări în industrie (ca pigmenți, în metalurgie etc.).
Calcarul (piatra de var) - CaCO3 se descompune în cuptoare speciale, la temperaturi de 1000°C, obținându-se, la scară industrială, varul nestins (CaO), care este unul dintre cele mai importante materiale de construcții.
Recunoașterea principalelor gaze rezultate în urma descompunerii unor substanțe :
a) Oxigenul este un gaz incolor care nu arde și care întreține arderea. El se recunoaște cu ajutorul unei așchii de brad cu puncte incandescente, care introdusă într-o atmosferă de oxigen pur se va aprinde și va arde cu o flacără vie.
b) Hidrogenul este un gaz incolor care arde și care nu întreține arderea. El se recunoaște cu ajutorul unui băț de chibrit aprins, care introdus într-o atmosferă de hidrogen îl va aprinde și va arde cu o flacără albăstruie. De multe ori se aude o pocnitură, deoarece hidrogenul cu oxigenul din aer formează un amestec exploziv.
c) Dioxidul de carbon este un gaz incolor care nu arde și care nu întreține arderea. El se recunoaște cu ajutorul unui băț de chibrit aprins, care introdus într-o atmosferă de CO2 va stinge flacăra.
Materiale necesare:
Apă carbogazoasă (sifon), hârtie de turnesol (de pH), paste.
Descrierea experimentului:
- Desfă dopul unei sticle de 0,5 L și introdu în apa carbogazoasă o hârtie de turnesol și câteva paste (preferabil mai ușoare și 3-4 bucăți).
- Ce observi ?
Apa carbogazoasă înroșește hârtia de turnesol, iar pastele sunt antrenate într-o mișcare continuă în apă.
Concluzia experimentului:
Apa carbogazoasă (sifonul) este acid carbonic și de aceea înroșește hârtia de turnesol.
Acidul carbonic se descompune în apă și dioxid de carbon.
Această reacție este reversibilă (în anumite condiții de lucru, pot decurge în ambele sensuri).
