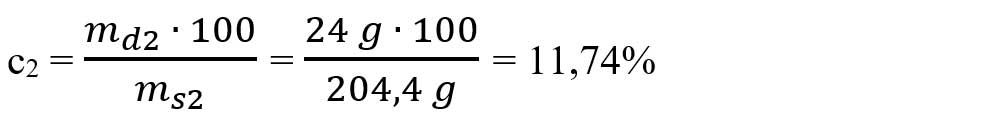V.6. Calcule stoechiometrice
- V.6.1. Calcule stoechiometrice cu exces de substanță.
- V.6.2. Calcule stoechiometrice cu randament.
- V.6.3. Calcule stoechiometrice cu concentrarea soluției în urma unei reacții.
V.6.1. Calcule stoechiometrice cu exces de substanță.
🔓 Problemă rezolvată - Calcule stoechiometrice cu exces de substanță
1. x g fier reacționează cu o soluție de acid clorhidric, obținându-se 381 g clorură de fier II. Știind că s-a lucrat cu un exces de Fe de 20%, determină masa x de Fe introdusă în reacție.
Rezolvare:
- Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
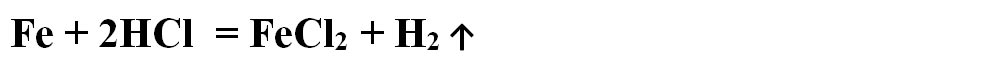
Aceasta se citește astfel: 1 mol de fier reacționează cu 2 moli de acid clorhidric și rezultă 1 mol de clorură de fier II și 1 mol de hidrogen.
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
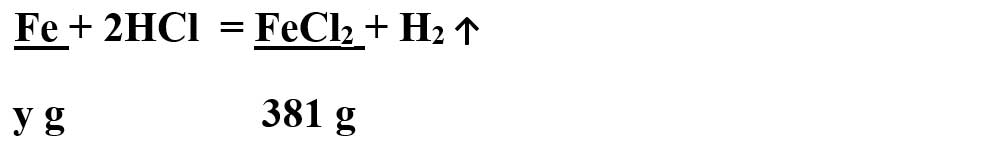
- Calculăm masa molară a FeCl2:
μ FeCl2 = 1 ∙ AFe + 2 ∙ ACl = 56 + 2 ∙ 35,5= 56 + 71 = 127 g/mol

- Calculăm masa de fier în exces :

-
Calculăm masa x de Fe introdusă în reacție:
- x = 168 g + 33,6 g = 201,6 g Fe introdus în reacție
V.6.2. Calcule stoechiometrice cu randament.
🔓 Problemă rezolvată - Calcule stoechiometrice cu randament
1. Cel mai răspândit minereu al fierului este hematitul (oxid de fier III).

La scară industrială fierul se obține pornind de la hematit (Fe2O3) printr-o reacție de reducere directă cu carbon, la temperaturi de cca. 2000°C, în furnale (cuptoare înalte). În partea superioară a furnalului se introduce minereul de fier și carbonul sub formă de cocs.
Știind că din 1000 kg hematit s-a obținut 630 kg fier, calculează randamentul acestei reacții.
Rezolvare:
mp = masa practică = 630 kg Fe
- Calculăm masa molară a Fe2O3 :
μ Fe2O3 = 2 ∙ AFe + 3 ∙ AO = 2 ∙ 56 + 3 ∙ 16 = 112 + 48 = 160 kg/kmol
AFe = 56 kg/kmol
- Scriem datele problemei pe ecuația chimică și calculăm masa teoretică a fierului obținută :

- Aplicăm formula randamentului unei reacții chimice și calculăm randamentul, știind că mp = masa practică = 630 kg Fe :
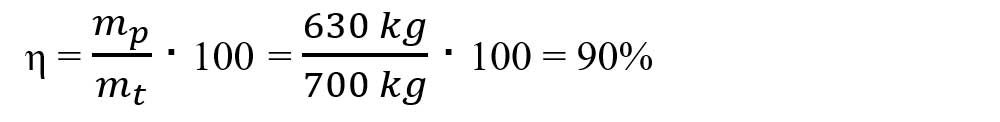
V.6.3. Calcule stoechiometrice cu concentrarea soluției în urma unei reacții.
🔓 Problemă rezolvată - Calcule stoechiometrice cu concentrarea soluției în urma unei reacții
1. În 200 g soluție hidroxid de sodiu de concentrație 8% se adaugă 4,6 g sodiu. Cât este concentrația procentuală a soluției obținute ?
Rezolvare:
-
Se scrie reacția chimică:
- Na + H2O -> NaOH + H2 ↑
-
Se scrie ecuația chimică:
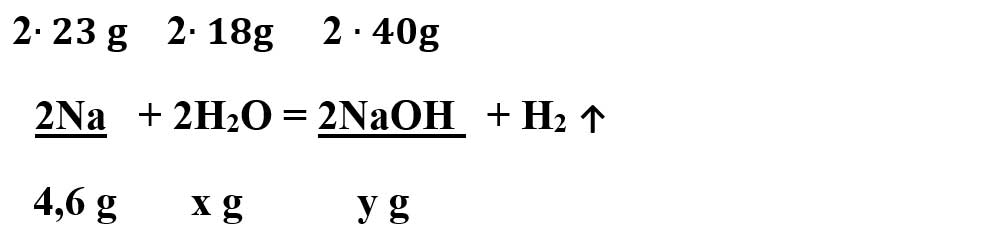
-
Se calculează masa molară a apei și a hidroxidului de sodiu:
-
μ H2O = 2 ∙ AH + 1 ∙ AO = 2 ∙ 1 + 1 ∙ 16 = 18 g/mol
-
μ NaOH = 1 ∙ ANa + 1 ∙ AO + 1 ∙ AH = 23 + 16 + 1 = 40 g/mol
-
-
Se calculează masa de apă și cea de NaOH:

- Se calculează masa de NaOH și de apă din soluția inițială notată cu 1:
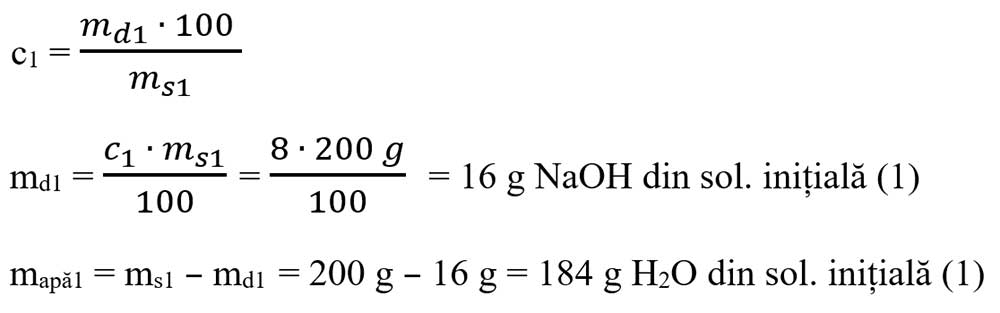
-
Se calculează masa apei neconsumată din eprubetă:
- mapă2 = mapă1 – x = 184 g – 3,6 g = 180,4 g H2O din sol. finală(2)
-
Se calculează masa de NaOH din soluția finală:
- md2 = md1 + y = 16 g + 8 g = 24 g NaOH din sol. finală(2)
-
Se calculează masa sol. finale de NaOH:
- ms2 = md2 + mapă2 = 24 g + 180,4 g = 204,4 g sol NaOH
- Se calculează concentrația procentuală a soluției obținute notată cu 2: