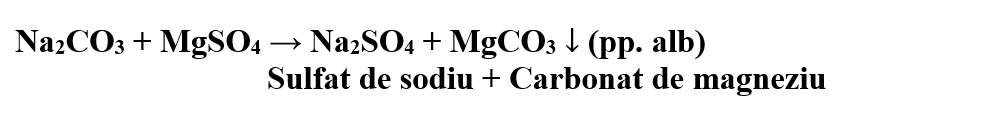VI.7. Reacția sărurilor cu sărurile
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Azotatul de argint este caustic și îți poate produce arsuri în contact cu pielea !
Materiale necesare:
Eprubetă, soluție de azotat de argint, soluție de clorură de sodiu, pipetă.
Descrierea experimentului:
- Pune în eprubetă puțină soluție de clorură de sodiu și adaugă câteva picături de azotat de argint.
- Ce observi ?
S-a format un precipitat alb.
Concluzia experimentului:
Clorura de sodiu – NaCl reacționează cu azotatul de argint - AgNO3 și se transformă în azotat
de sodiu – NaNO3 și clorură de argint - AgCl (precipitat alb). Această reacție este folosită în laborator
pentru recunoașterea acidului clorhidric și a sărurilor lui, cloruri.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
NaCl + AgNO3 = NaNO3 + AgCl ↓
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Acetatul de plumb este toxic și iritant!
🔥 Atenție, când lucrezi cu lichide fierbinți!
Materiale necesare:
2 pahare Berzelius, 1 pahar Erlenmeyer, acetat de plumb, iodură de potasiu, apă distilată (deionizată), spirtieră,
trepied cu sită de azbest, cântar, termometru, pâlnie, hârtie de filtru.
Descrierea experimentului:
- Cântărește prima dată 2,4 g de iodură de potasiu și pune-le într-un pahar Berzelius. Adaugă apoi în paharul Berzelius 100 ml de apă distilată și amestecă utilizând o spatulă pentru dizolvarea iodurii de potasiu.
- Cântărește apoi tot 2,4 g de acetat de plumb și pune-le într-un pahar Berzelius, adaugă 100 ml de apă distilată și amestecă utilizând o spatulă pentru dizolvarea acetatului de plumb.
- Adaugă o soluție peste cealaltă.
- Ce observi ?
S-a format un precipitat portocaliu.
Concluzia experimentului:
Acetatul de plumb - Pb(CH3COO)2 reacționează cu iodura de potasiu - KI și se transformă în
acetat de potasiu - KCH3COO și iodură de plumb - PbI2 (precipitat portocaliu).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două
substanțe compuse:
Pb(CH3COO)2 + 2 KI = 2 KCH3COO + PbI2 ↓
Descrierea experimentului:
- Încălzește apoi precipitatul obținut (suspensia) cu ajutorul spirtierei, trepiedului și sitei de azbest și amestecă utilizând o spatulă.
- Când temperatura suspensiei ajunge la 90 ° (verifică temperatura lichidului cu ajutorul termometrului), stinge spirtiera și toarnă lichidul într-un pahar Erlenmeyer pe gura căruia ai pus pâlnia cu hârtia de filtru. În paharul
- Erlenmeyer s-a filtrat o soluție de iodură de plumb care se lasă la răcit.
- Ce observi ?
Prin răcire lentă soluția de iodură de plumb recristalizează formând cristale aurii hexagonale de PbI2 (ploaia de aur).
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Clorura de mercur este extrem de toxică!
🔥 Atenție, când lucrezi cu surse de foc!
Materiale necesare:
2 pahare Berzelius, 1 pahar Erlenmeyer, baghetă, clorură de mercur, iodură de potasiu, apă distilată (deionizată),
spirtieră, trepied cu sită de azbest, pâlnie, hârtie de filtru, sticlă de ceas.
Descrierea experimentului:
- Pune 1-2g de clorură de mercur într-un pahar Berzelius. Adaugă apoi în paharul Berzelius 20 ml apă distilată și amestecă utilizând o baghetă pentru dizolvarea clorurii de mercur.
- Pune 1-2g de iodură de potasiu într-un pahar Berzelius, adaugă 20 ml de apă distilată și amestecă utilizând o baghetă pentru dizolvarea iodurii de potasiu.
- Adaugă o soluție peste cealaltă.
- Ce observi ?
S-a format un precipitat portocaliu intens.
Concluzia experimentului:
Clorura de mercur - HgCl2 reacționează cu iodura de potasiu - KI și se transformă în clorură de
potasiu - KCl și iodură de mercur - HgI2 (precipitat portocaliu intens).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
HgCl2 + 2 KI = 2 KCl + HgI2↓
Descrierea experimentului:
- Filtrează precipitatul obținut într-un pahar Erlenmeyer pe gura căruia ai pus p�âlnia cu hârtia de filtru. În paharul Erlenmeyer se va filtra clorura de potasiu, iar pe hârtia de filtru va rămâne precipitatul de iodură de mercur.
- Ia o cantitate mică din acest precipitat de iodură de mercur și pune-o pe o sticlă de ceas.
- Încălzește apoi sticla de ceas cu precipitatul de iodură de mercur, cu ajutorul spirtierei, trepiedului și sitei de azbest.
- Ce observi ?
Pe măsură ce temperatura crește culoarea precipitatului de iodură de mercur se schimbă din portocaliu intens în galben, fenomen cunoscut sub denumirea de termocromism.
Descrierea experimentului:
- Lasă sticla de ceas cu precipitatul de iodură de mercur să se răcească.
- Ce observi ?
Odată cu scăderea temperaturii culoarea precipitatului de iodură de mercur se schimbă din nou, de data aceasta din galben în portocaliu intens, revenind la culoarea inițială.
🔥 Atenție! Acest experiment se efectuează numai de către profesori!
🔥 Atenție! Dicromatul de potasiu este coroziv, oxidant, foarte toxic, nociv și periculos pentru mediu!
🔥 Atenție! Azotatul de argint este toxic și caustic!
🔥 Atenție! Dicromatul de argint este toxic, periculos pentru mediu, iritant pentru piele, ochi și tractul respirator.
Materiale necesare:
Soluție de dicromat de potasiu, soluție de azotat de argint, eprubetă/sticlă de ceas, pipetă, soluție de acid azotic 38%, bijuterie de argint, un obiect de alamă/cupru, un obiect de zinc, un obiect de plumb, un obiect de aur.
Descrierea experimentului:
- Se pun câteva picături de soluție de dicromat de potasiu într-o sticlă de ceas și apoi se adaugă cu pipeta câteva picături de soluție de azotat de argint.
- Ce observi ?
În urma reacției se formează un precipitat de culoare roșu-brun, care reprezintă dicromatul de argint, insolubil în soluția obținută
Concluzia experimentului:
Reacția dintre dicromatul de potasiu și azotatul de argint are loc cu formarea azotatului de potasiu (KNO3 ) și a dicromatului de argint (Ag2Cr2O7), un precipitat de culoare roșu-brun.
K2Cr2O7 + 2 AgNO3 = 2 KNO3 + Ag2Cr2O7 ↓
Reacția dintre dicromatul de potasiu și azotatul de argint are ca aplicație practică testarea unor metale, în mod deosebit a argintului. Astfel, se folosește dicromatul de potasiu dizolvat în soluție de acid azotic de concentrație 35%, soluția numită soluția lui Schwerter.
Înainte de a aplica soluția Schwerter, obiectele metalice se curăță pe o mică suprafață a lor cu un cuțit sau hârtie abrazivă, pentru a îndepărta stratul de oxid format cu oxigenul din aer. Apoi se adaugă soluția Schwerter pe diferite obiecte metalice.
Vom observa că:
- argintul pur va colora soluția Schwerter în roșu deschis.
- argintul sterlin cu un titlu de 925 (are 92,5% de argint și de 7,5% de alte metale, în general cuprul) o va colora în roșu închis.
- argintul monetar o va colora în maro (în mare parte datorită conținutului mare de cupru).
- cuprul sau alama (aliaj Cu-Zn) colorează soluția Schwerter în maro închis.
- plumbul și zincul colorează soluția Schwerter în galben.
- aurul și platina nu schimbă culoarea soluției Schwerter.
👀 Experiment:Reacția dintre acetatul de plumb și cromatul de potasiu
🔥 Atenție! Acetatul de plumb este toxic și periculos pentru mediu acvatic !
🔥 Atenție! Cromatul de potasiu este o substanță foarte toxică, corozivă și periculoasă pentru mediu!
Materiale necesare:
Eprubetă, soluție de acetat de plumb, soluție de cromat de potasiu, spatulă, pipetă.
Descrierea experimentului:
- Pune în eprubetă soluția de acetat de plumb și adaugă cu pipeta soluție de cromat de potasiu.
- Ce observi ?
S-a format un precipitat galben de cromat de plumb.
Concluzia experimentului:
Cromatul de potasiu precipită din soluțiile sărurilor de plumb cromatul de plumb, de culoare galbenă:
Pb2+ + (2K+ + CrO4-2) → PbCrO4 ↓ + 2K+
Pb(CH3COO)2 + K2CrO4 → PbCrO4 ↓ + 2 KCH3COO
Acetat de plumb + cromat de potasiu → cromat de plumb + acetat de potasiu
Materiale necesare:
Sticlă de ceas sau eprubetă, soluție de carbonat de sodiu, soluție de sulfat de magneziu, pipetă.
Descrierea experimentului:
- Pune pe sticla de ceas câteva picături de soluție de Na2CO3 și adaugă soluție de MgSO4 până la precipitare.
- Ce observi ?
S-a format un precipitat alb de carbonat de magneziu.
Concluzia experimentului:
Sulfatul de magneziu precipită din soluțiile carbonaților, carbonatul de magneziu, un precipitat alb.