Cap.II. Transformări chimice ale substanţelor.
Probleme rezolvate.
2.1. Scrie ecuația reacției dintre hidrogen ( H2 ) și oxigen ( O2 ) :
-
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- H2 + O2 => H2O
-
Apoi facem bilanțul atomilor.
-
Intră 2 atomi de H și ies tot 2 atomi de H.
-
Intră 2 atomi de O și iese 1 atom de O. Pentru a realiza egalitatea atomilor de oxigen, punem coeficientul 2 în fața formulei apei: (Atenție ! Nu pune coeficienții în interiorul formulei, ci în fața ei!)
-
H2 + O2 => 2H2O. Dar, punând 2 în fața apei, acum vor ieși 4 atomi de hidrogen și am stricat egalitatea atomilor de H. Prin urmare, punem coeficientul 2 și în fața hidrogenului:
-
2H2 + O2 => 2 H2O.
-
-
Facem verificarea finală: intră 4 atomi de H (2 coeficientul ∙ 2 indicele H) și ies tot 4 atomi de H (2 coeficientul ∙ 2 indicele H).
-
Intră 2 atomi de O (1 coeficientul ∙ 2 indicele O) și ies tot 2 atomi de O (2 coeficientul ∙ 1 indicele O).
-
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 2H2 + O2 = 2 H2O
2.2. Scrie ecuația reacției dintre aluminiu ( Al ) și oxigen ( O2 ) :
-
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- Al + O2 => Al2O3 (oxid de aluminiu)
-
Apoi facem bilanțul atomilor.
-
Intră 1 atom de Al și ies 2 atomi de Al. Punem coeficientul 2 în fața simbolului Al:
- 2Al + O2 => Al2O3
-
Intră 2 atomi de O și ies 3 atomi de O. Pentru a realiza egalitatea atomilor de oxigen, punem coeficientul 2 în fața formulei oxidului de aluminiu și coeficientul 3 în fața oxigenului (Când avem într-o parte 2 atomi și în cealaltă parte 3 atomi, se face produsul lor):
- 2Al + 3O2 => 2Al2O3
-
Dar, punând 2 în fața oxidului, am stricat egalitatea atomilor de Al (Acum ies 4 atomi de Al). Prin urmare, ștergem coeficientul 2 și punem coeficientul 4 și în fața aluminului. Vă recomand să scrieți cu creionul sau cu pix pilot, pentru a putea șterge cu guma:
- 4Al + 3O2 => 2Al2O3
-
Facem verificarea finală: intră 4 atomi de Al și ies tot 4 atomi de Al.
-
Intră 6 atomi de O (coeficientul 3 ori indicele 2) și ies tot 6 atomi de O (coeficientul 2 ori indicele 3).
-
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 4Al + 3O2 = 2Al2O3
2.3. Scrie ecuația reacției dintre aluminiu ( Al ) și acid clorhidric ( HCl ):
-
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție :
- Al + HCl => AlCl3 (clorură de aluminiu) + H2
-
Apoi facem bilanțul atomilor.
-
Intră 1 atom de Al și iese 1 atom de Al.
-
Intră 1 atom de H și ies 2 atomi de H. Pentru a realiza egalitatea atomilor de H, punem coeficientul 2 în fața formulei acidului clorhidric (HCl) :
- Al + 2HCl => AlCl3 + H2
-
Intră 2 atomi de Cl și ies 3 atomi de Cl. Punem coeficientul 6 în fața HCl și coeficientul 2 în fața AlCl3 :
- Al + 6HCl => 2AlCl3 + H2. Observăm că am stricat atît bilanțul atomilor de Al și punem în fața Al coeficientul 2, cât și bilanțul atomilor de H și punem coeficientul 3 în fața H2 :
- 2Al + 6HCl => 2AlCl3 + 3H2
-
Facem verificarea finală: intră 2 atomi de Al și ies tot 2 atomi de Al.
-
Intră 6 atomi de H și ies tot 6 atomi de H (coeficientul 3 ori indicele 2).
-
Intră 6 atomi de Cl și ies tot 6 atomi de Cl (coeficientul 2 ori indicele 3).
-
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică :
- 2Al + 6HCl = 2AlCl3 + 3H2
2.4. Scrie ecuația reacției dintre acid fosforic - H3PO4 și hidroxid de magneziu - Mg(OH)2 :
-
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- H3PO4 + Mg(OH)2 => Mg3(PO4)2 (Fosfat de magneziu) + H2O
-
Apoi facem bilanțul atomilor.
-
Când grupările radicalilor acizi se regăsesc și la produși, facem bilanțul grupărilor și nu al atomilor grupării (este mai simplu) și spunem intră 1 grupare fosfat (PO4) și ies 2 grupări fosfat (PO4)2. Punem coeficientul 2 în fața acidului fosforic:
- 2H3PO4 + Mg(OH)2 => Mg3(PO4)2 + H2O
-
Intră 1 atom de Mg și ies 3 atomi de Mg. Pentru a realiza egalitatea atomilor de Mg , punem coeficientul 3 în fața formulei hidroxidului de magneziu :
- 2H3PO4 + 3Mg(OH)2 => Mg3(PO4)2 + H2O
-
Intră 12 atomi de H (2x3=6 de la acidul fosforic + 3x2=6 de la hidroxidul de magneziu) și ies 2 atomi de H. Punem coeficientul 6 în fața apei:
- 2H3PO4 + 3Mg(OH)2 => Mg3(PO4)2 + 6H2O
-
Mai avem bilanțul atomilor de oxigen: intră 6 atomi de O (luăm numai oxigenul de la hidroxidul de magneziu, fiindcă O din acidul fosforic l-am luat la grupări) și ies tot 6 atomi de oxigen.
-
Facem verificarea finală: intră 12 atomi de H și ies tot 12 atomi de H.
-
Intră 2 grupări PO4 și ies tot 2 grupări fosfat.
-
Intră 3 atomi de Mg și ies tot 3 atomi de Mg.
-
Intră 6 atomi de O și ies tot 6 atomi de O.
-
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 2H3PO4 + 3Mg(OH)2 = Mg3(PO4)2 + 6H2O
2.5. 20 g de sulfat de cupru II reacționează cu hidroxidul de sodiu.
Se cere :
a) Câți moli de hidroxid de sodiu reacționează cu 20 g de sulfat de cupru II ?
b) Ce masă de sulfat de sodiu se obține ?
Rezolvare
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
- CuSO4 + 2 NaOH = Na2SO4 + Cu(OH)2 ↓
Aceasta se citește astfel: 1 mol de sulfat de cupru II reacționează cu 2 moli de hidroxid de sodiu și formează 1 mol de sulfat de sodiu și 1 mol de hidroxid de cupru.
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe :
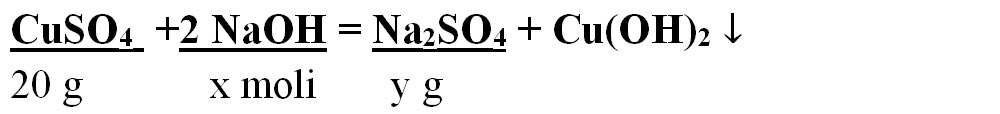
-
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței, iar pentru cele care se dau sau se cer în moli se trece numărul de moli, astfel încât să avem aceeași unitate de măsură și sub substanță și deasupra ei.
-
Calculăm masele molare ale sulfatului de cupru și sulfatului de sodiu :
-
μCuSO4 = 1 ∙ ACu + 1 ∙ AS + 4 ∙ AO = 64 + 32 + 4 ∙ 16 = 96 + 64 = 160 g/mol
-
μNa2SO4 = 2 ∙ ANa + 1 ∙ AS + 4 ∙ AO = 2 ∙ 23 + 32 + 4 ∙ 16 = 46 + 32 + 64 = 142 g/mol
-
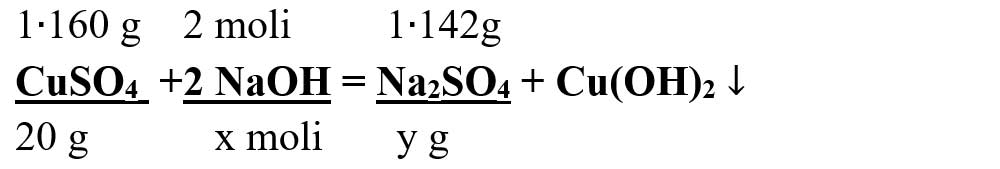
- Din proporțiile astfel obținute se calculează necunoscutele :

Exerciții.
2.6. Scrie ecuațiile următoarelor reacții chimice :
a) Na + Cl2 → NaCl
b) Fe + Br2 → FeBr3
c) C + CuO → Cu ↓ + CO2 ↑
d) HNO3 + Ca(OH)2 → Ca(NO3)2 + H2O
e) Al + H2SO4 → Al2(SO4)3 + H2 ↑
f) H2O2 → H2O + O2 ↑
2.7. 5 moli de acid azotic reacționează cu hidroxidul de calciu.
Se dă reacția: HNO3 + Ca(OH)2 → Ca(NO3)2 + H2O
Se cere :
a) Masa de azotat de calciu rezultată.
b) Nr. de moli de apă rezultați.
c) Masa de hidroxid de calciu care reacționează cu acidul azotic.
Test de autoevaluare.
2.8. Scrie ecuațiile următoarelor reacții chimice: –4,5p
a) K + Cl2 → KCl
b) Fe + I2 → FeI3
c) Ca(OH)2 + HF → CaF2 + H2O
d) H2SO4 + NaBr → Na2SO4 + HBr
e) Al + H2SO3 → Al2(SO3)3 + H2 ↑
f) AlCl3 + ZnS → ZnCl2 + Al2S3
g) H3PO4 + Zn(OH)2 → Zn3(PO4)2 + H2O
h) K3PO4 + MgCO3 → Mg3(PO4)2 + K2CO3
i) KOH + Hg3(PO4)2 → K3PO4 + Hg(OH)2 ↓
2.9. Completează următoarele afirmații: -1,5p
a) Reactanții nu se consumă în orice cantitate, ci în proporții bine …………… .
b) Reacția chimică conservă …………… elementelor chimice participante.
c) Numărul atomilor intrați în reacție este …………… cu numărul atomilor ieșiți din reacție -Legea conservării numărului ………………… .
d) Masa totală a reactanților este egală cu........................................a produșilor de reacție - Legea conservării ……………….
2.10. Se dă reacția: H2SO4 + KOH → K2SO4 + H2O –3p
180g de acid sulfuric reacționează cu hidroxidul de potasiu. Se cere:
a) Masa de sulfat de potasiu rezultată.
b) Nr. de moli de apă rezultați.
c) Masa de hidroxid de potasiu care reacționează cu acidul sulfuric.
Oficiu –1p