Cap.VI. Reacția de schimb.
Probleme rezolvate.
6.1. Într-un pahar Berzelius care conține o soluție de azotat de zinc, se adaugă 50 g sol. NaOH 16%. Precipitatul format, spălat și uscat cântărește 9,5 g. Calculează randamentul de transformare a NaOH în Zn(OH)2.
- Calculăm masa de NaOH din soluția dată :
100 g sol NaOH………16 g NaOH
50 g sol NaOH……….x g NaOH
x = 8 g NaOH
- Calculăm masele molare a NaOH și Zn(OH)2 :
μ NaOH =1 ∙ ANa + 1 ∙ AO + 1 ∙ AH = 23 + 16 + 1= 40 g/mol
μ Zn(OH)2 = 1 ∙ AZn + 2 ∙ AO + 2 ∙ AH = 65 + 2 ∙ 16 + 2 ∙ 1 = 99 g/mol
- Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
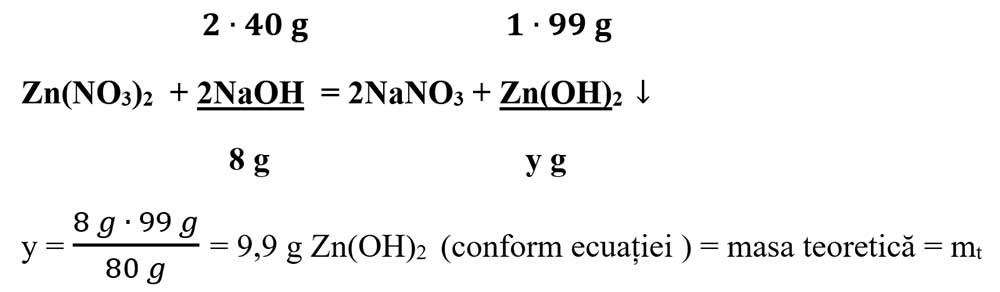
- Calculăm randamentul reacției:
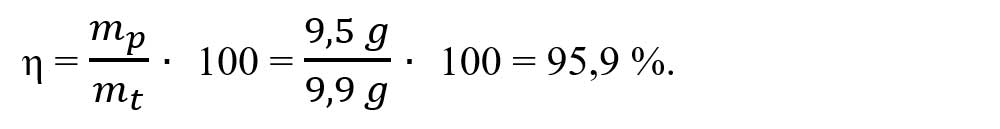
6.2. Se ard 400 g pucioasă (sulf) cu 80% puritate. Produsul rezultat se barbotează în 720 mL apă, rezultând o substanță care înroșește hârtia de turnesol. În vas se introduce o soluție de hidroxid de sodiu (sodă caustică) 40%.
Se cere:
a) Ce volum de oxigen s-a consumat pentru arderea sulfului ?
b) Masa substanței rezultată din a doua reacție chimică.
c) Masa de sodă caustică, de sare și apă rezultate din a treia reacție chimică.
d) Masa de apă rămasă în vas.
e) Concentrația procentuală de masă a soluției finale de sare.
Rezolvare :
a) Calculăm masa de sulf pur:

- Calculăm volumul de oxigen consumat pentru arderea sulfului și masa de SO2 obținută din prima reacție:
μ SO2 = 1 ∙ AS + 2 ∙ AO = 32 + 2 ∙ 16 = 64 g/mol
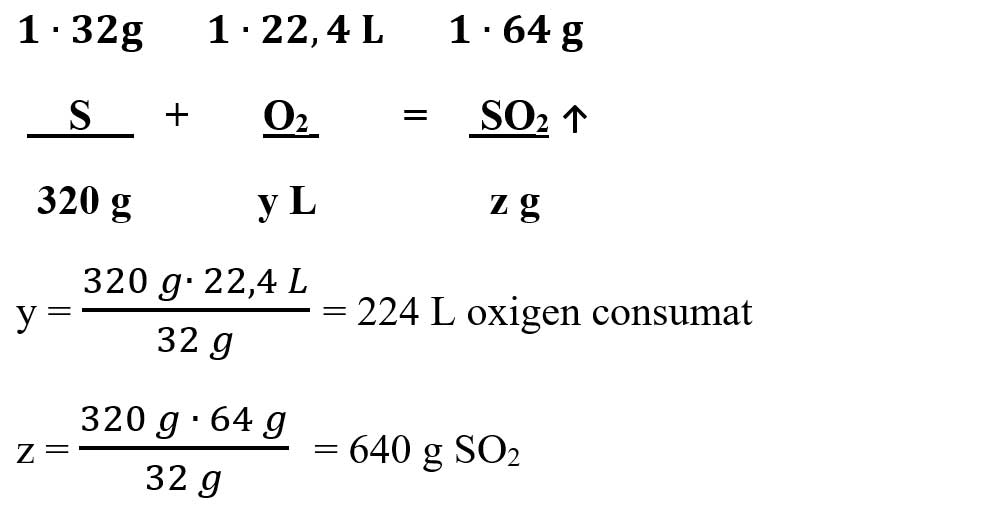
b) Scriem a II-a reacție chimică, calculăm masele molare ale H2O și H2SO3, punem datele problemei pe ecuație și calculăm necunoscutele:
μ H2O = 2 ∙ AH + 1 ∙ AO = 2 ∙ 1 + 1 ∙ 16 = 18 g/mol
μ H2SO3 = 2 ∙ AH + 1 ∙ AS + 3 ∙ AO = 2 + 32 + 48 = 82 g/mol
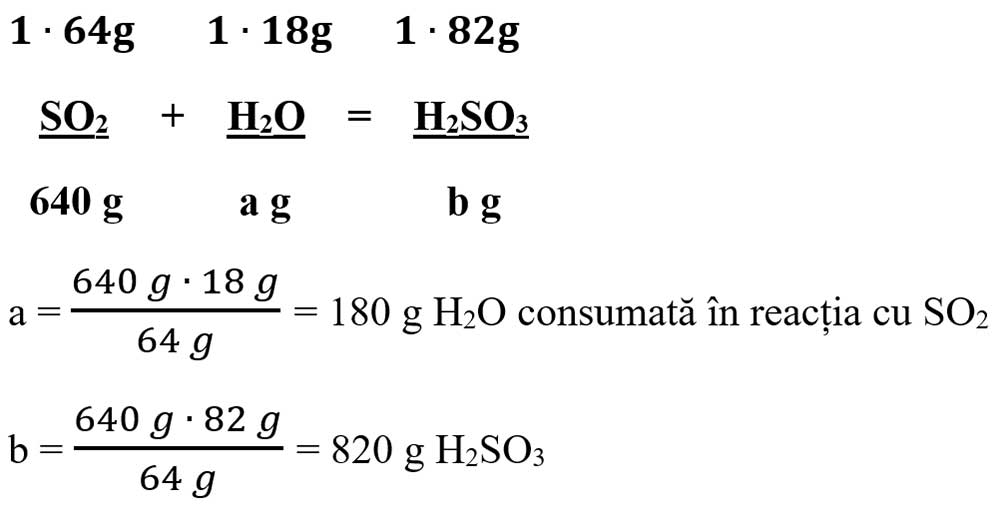
c) Scriem a III-a reacție chimică, calculăm masele molare ale NaOH, Na2SO3, punem datele problemei pe ecuație și calculăm necunoscutele:
μ NaOH = 1 ∙ ANa + 1 ∙ AO + 1 ∙ AH = 1 ∙ 23 + 1 ∙ 16 + 1 ∙ 1 = 40 g/mol
μ Na2SO3 = 2 ∙ ANa + 1 ∙ AS + 3 ∙ AO = 46 + 32 + 48 = 126 g/mol
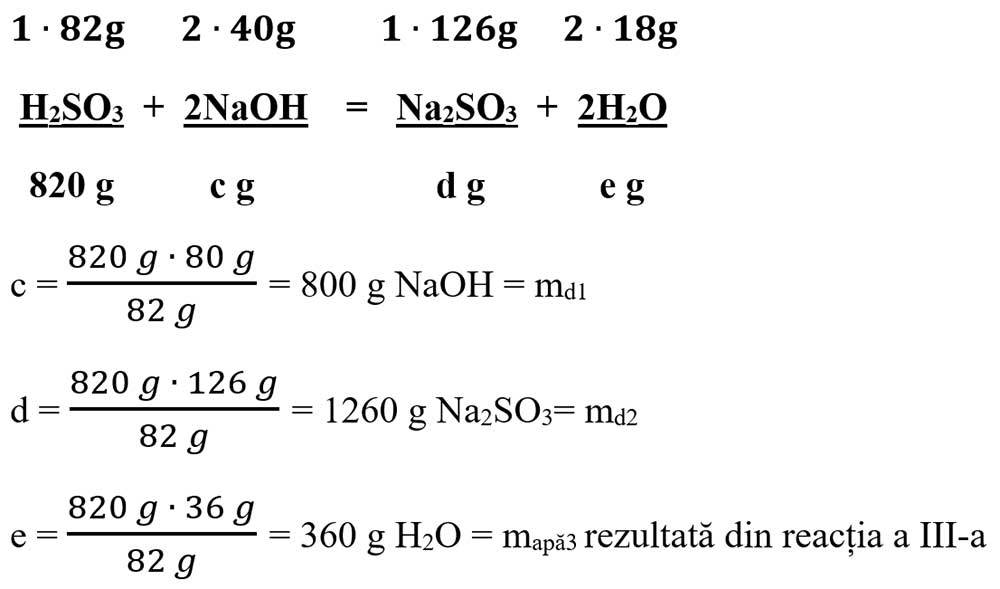
d) Apa rămasă în vas o calculăm adunând
-
Apa pusă în a II-a reacție și neconsumată :
-
720 mL apă cântărește 720 g apă deoarece apa are densitatea de 1g/1mL.
-
mapă1 = 720 g – 180 g = 540 g apă care nu a reacționat cu SO2 (în exces).
-
-
Apa din soluția de NaOH de concentrație 40% :
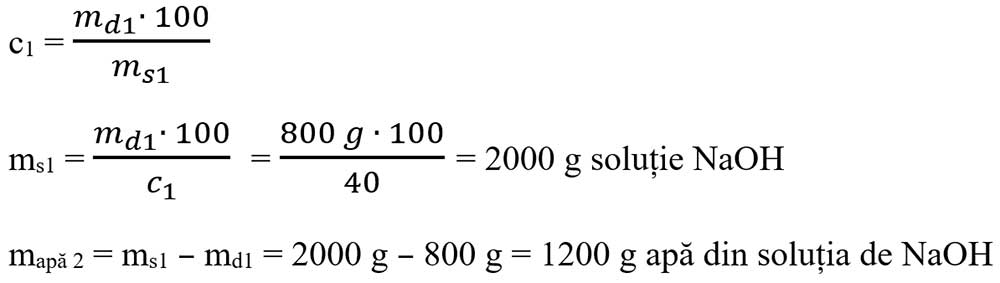
-
Apa rezultată din a III-a reacție :
-
mapă3 rezultată din reacția a III-a = 360 g
-
mapă vas = 540 g + 1200 g + 360 g = 2100 g apă rămasă în vas.
-
e) Pentru a calcula concentrația soluției de sare (Na2SO3), calculăm masa soluției și apoi aplicăm formula concentrației:
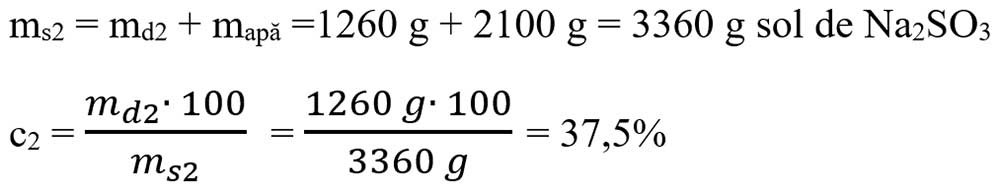
6.3. Scrie formulele chimice ale produșilor de reacție (inclusiv denumirile lor) corespunzătoare literelor a-d și apoi scrie ecuațiile chimice ale acestor reacții:
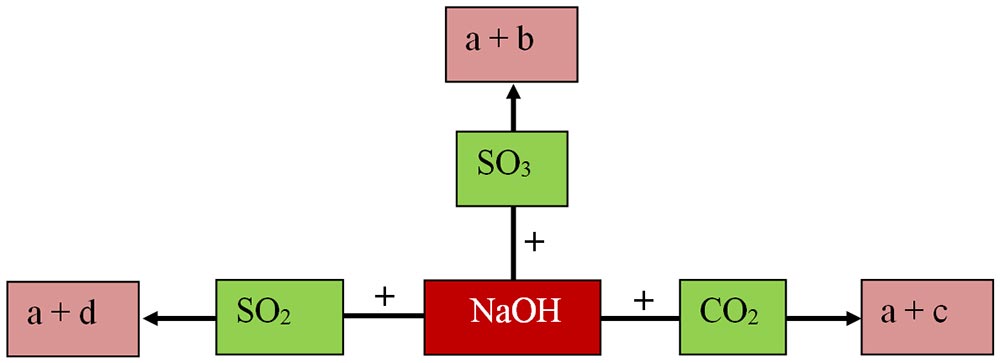
Rezolvare:
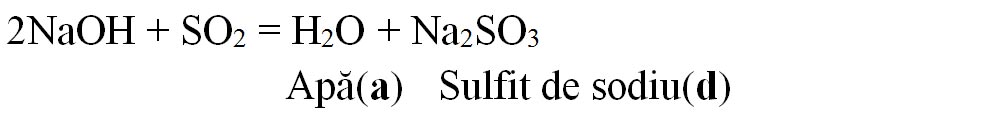
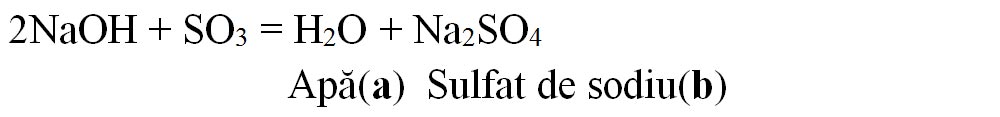
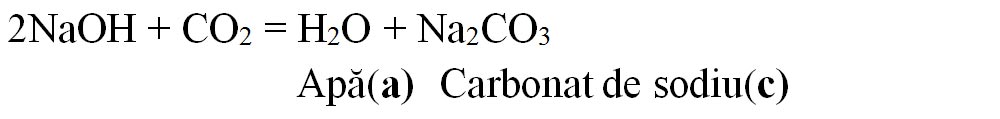
6.4. Apa dură are un conținut ridicat de săruri solubile de calciu și de magneziu, cu efecte negative atât în activitatea industrială, cât și în gospodărie. Pentru înlăturarea sărurilor de calciu și de magneziu se poate folosi carbonatul de sodiu, procedeu numit dedurizarea apei dure.
a) Scrie ecuațiile reacțiilor chimice dintre carbonatul de sodiu și sulfatul de calciu, respectiv clorura de magneziu.
b) Calculează masa totală de carbonat de sodiu necesară pentru a reacționa cu 150 mg de sulfat de calciu și cu 100 mg de clorură de magneziu, care se află într-o probă de apă dură.
Rezolvare:
-
Calculăm masele molare ale substanțelor subliniate:
-
μ CaSO4 = 1 ∙ ACa + 1 ∙ AS + 4 ∙ AO = 40 + 32 + 64 = 136 mg/mmol
-
μ Na2CO3 = 2 ∙ ANa + 1 ∙ AC + 3 ∙ AO = 46 + 12 + 48 = 106 mg/mmol
-
μ MgCl2 = 1 ∙ AMg + 2 ∙ ACl = 24 + 71 = 95 mg/mmol
-
-
Scriem ecuațiile chimice:
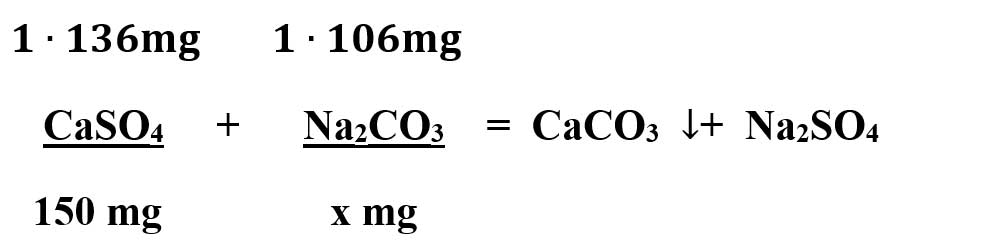
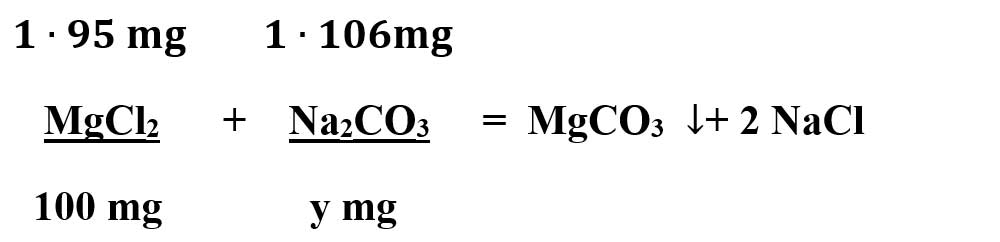
- Calculăm necunoscutele x și y:
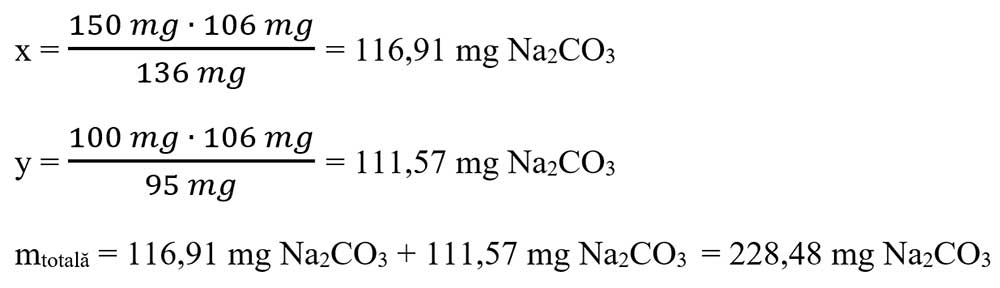
6.5. Ce concentrație are soluția de sare obținută în urma reacției dintre 210 g soluție carbonat de magneziu 20% cu o soluție de acid sulfuric 40% ? Se dau masele atomice: AS = 32 g/mol, AO = 16 g/mol, AC = 12 g/mol, AH = 1 g/mol, AMg = 24 g/mol.
Rezolvare:
- Scriem ecuația reacției chimice:
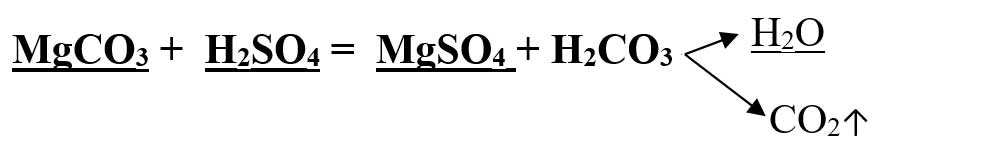
- Calculăm masele molare ale substanțelor subliniate:
μ MgCO3 = 1 ∙ AMg + 1 ∙ AC + 3 ∙ AO = 24 + 12 + 48 = 84 g/mol
μ H2SO4 = 2 ∙ AH + 1 ∙ AS + 4 ∙ AO = 2 + 32 + 64 = 98 g/mol
μ MgSO4 = 1 ∙ AMg + 1 ∙ AS + 4 ∙ AO = 24 + 32 + 64 = 120 g/mol
μ H2O = 2 ∙ AH + 1 ∙ AO = 2 + 16 = 18 g/mol
- Calculăm masa de carbonat de magneziu din soluția dată:
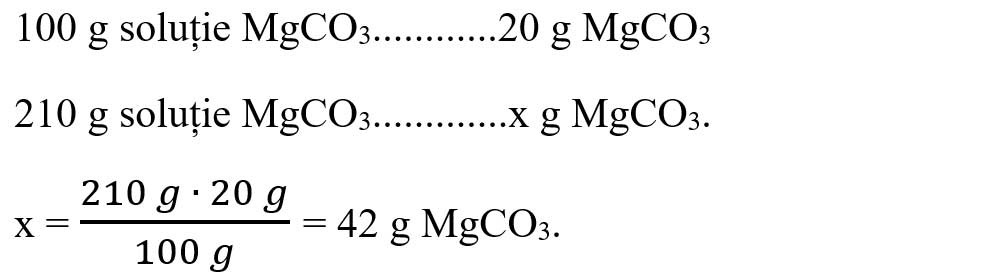
- Scriem ecuația reacției chimice, scriem datele problemei pe ecuație:
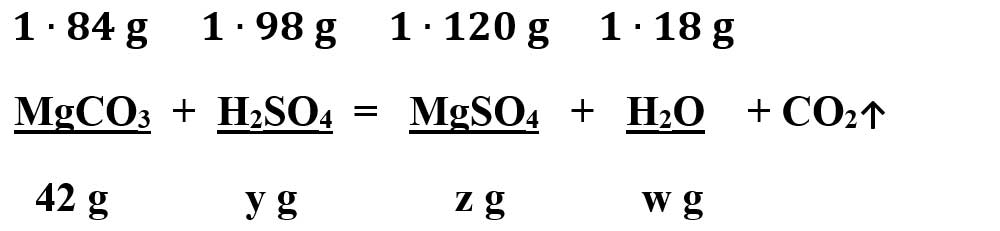
- Calculăm masa de H2SO4 conform ecuației chimice:

-
Calculăm masa de MgSO4 conform ecuației chimice:
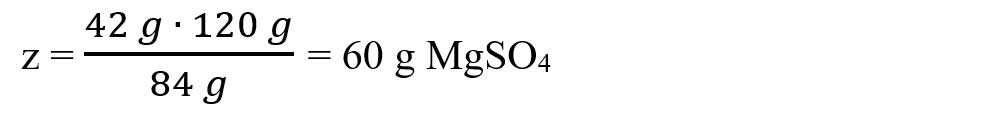
-
Calculăm masa de H2O conform ecuației chimice:
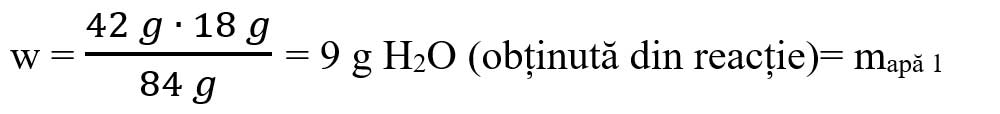
- Calculăm masa soluției de H2SO4 din formula concentrației:
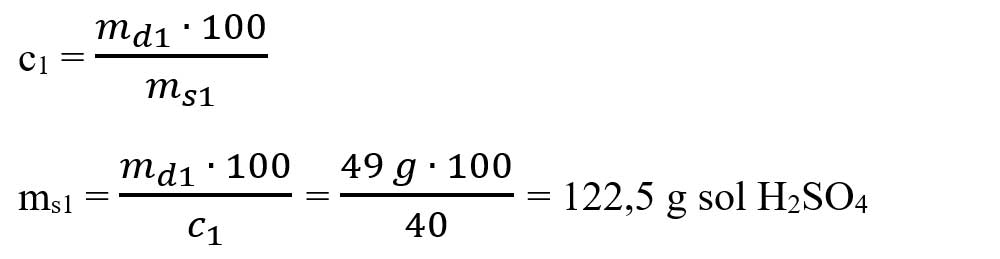
- Calculăm masa de apă din soluția de H2SO4
mapă 2 = 122,5 g – 49 g = 73,5 g apă
- Calculăm masa de apă din soluția de MgCO3:
mapă 3 = 210 g – 42 g = 168 g apă
- Calculăm masa de apă totală care va dizolva MgSO4 obținut din reacție:
mapă totală = mapă 1 + mapă 2 + mapă 3 = 9 g + 168 g + 73,5 g = 250,5 g apă
- Calculăm masa soluției de MgSO4:
ms2 = mapă totală + md2 = 250,5 g apă + 60 g MgSO4 = 310,5 g sol MgSO4
- Calculăm concentrația soluției de MgSO4:
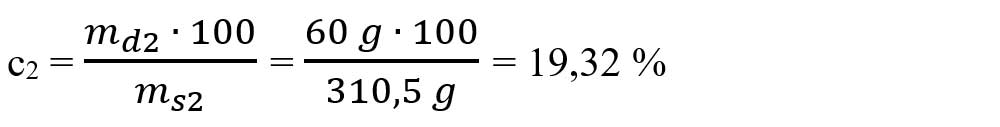
6.6. Scrie ecuațiile chimice și tipul fiecărei reacții chimice:
6.6.1. Obținerea oxizilor:
-
6.6.1.A. Metal / nemetal + oxigen = oxid metalic / oxid nemetalic (Reacție de combinare)
-
3Fe + 2O2 = Fe3O4
-
S + O2 = SO2
-
-
6.6.1.B. Descompunerea carbonaților = oxid metalic + oxid nemetalic (Reacție de descompunere)
- MgCO3 = MgO + CO2↑
-
6.6.1.C. Deshidratarea unor oxiacizi / hidroxizi = apă + oxid (Reacție de descompunere)
-
H2SO3 = H2O + SO2↑
-
Cu(OH)2 = H2O + CuO
-
-
6.6.1.D. Reacția dintre un oxid metalic + Al = oxid de aluminiu + metal (Reacție de substituție)
- Fe2O3 + 2Al = Al2O3 + 2Fe
6.6.2. Obținerea acizilor:
-
6.6.2.A. Oxid nemetalic + apă = oxiacid (Reacție de combinare)
-
SO2 + H2O = H2SO3
-
CO2 + H2O = H2CO3
-
-
6.6.2.B. Acid tare + sare = acid mai slab + sare (Reacție de schimb)
- 3H2SO4 + 2Na3PO4 = 2H3PO4 + 3Na2SO4
6.6.3. Obținerea bazelor:
-
6.6.3.A. Metal alcalin + apă = bază alcalină + hidrogen (Reacție de substituție)
- 2Na + 4H2O = 2NaOH + H2↑
-
6.6.3.B. Soluție sare + bază alcalină = sare + bază (Reacție de schimb)
- Zn3(PO4)2 + 6NaOH = 2Na3PO4 + 3Zn(OH)2
-
6.6.3.C. Oxid metalic + apă = hidroxid (Reacție de combinare)
- K2O + H2O = 2KOH
6.6.4. Obținerea sărurilor:
-
6.6.4.A. Metal + nemetal = sare (Reacție de combinare)
- 2Fe + 3Cl2 = 2FeCl3
-
6.6.4.B. Acid + bază = sare + apă (Reacție de schimb)
- 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
-
6.6.4.C. Oxid nemetalic (oxid acid) + bază = sare + apă (Reacție de schimb)
- CO2 + 2KOH = K2CO3 + H2O
-
6.6.4.D. Oxid metalic (oxid bazic) + acid = sare + apă (Reacție de schimb)
- 3Na2O + 2H3PO4 = 2Na3PO4 + 3H2O
-
6.6.4.E. Acid + sare = acid + sare (Reacție de schimb)
- 6HCl + Fe2S3 = 2FeCl3 + 3H2S
-
6.6.4.F. Bază + sare = bază + sare (Reacție de schimb)
- 2Al(OH)3 + 3HgI2 = 3Hg(OH)2↓ + 2AlI3
Exerciții.
6.7. Scrie ecuațiile chimice și tipul fiecărei reacții chimice :
a) Al + Fe2O3 => Fe + Al2O3
b) Na2O + H3PO4 => Na3PO4 + H2O
c) Fe + F2 => FeF3
d) H2CO3 => H2O + CO2 ↑
e) NH3 + H2O => NH4OH
f) MgCO3 => MgO + CO2 ↑
g) Zn(OH)2 + HNO3 => Zn(NO3)2 + H2O
h) NiO + C => Ni + CO2 ↑
6.8. Scrie formulele chimice ale substanțelor lipsă în locurile punctate, apoi ecuațiile chimice și tipul fiecărei reacții chimice:
a) KOH + Al2(CO3)3 => ........ + Al(OH)3
b) Zn + HNO3 => Zn(NO3)2 + ........
c) Zn + ....... => ZnO
d) ........ => CaO + CO2 ↑
6.9. Scrie formulele chimice ale produșilor de reacție (inclusiv denumirile lor) corespunzătoare literelor a-d și apoi scrie ecuațiile chimice ale acestor reacții:
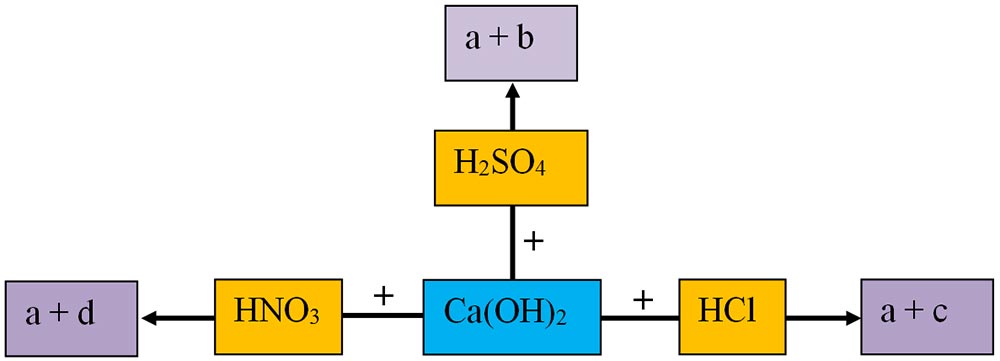
6.10. Scrie formulele chimice ale produșilor de reacție (inclusiv denumirile lor) corespunzătoare literelor a-d și apoi scrie ecuațiile chimice ale acestor reacții:
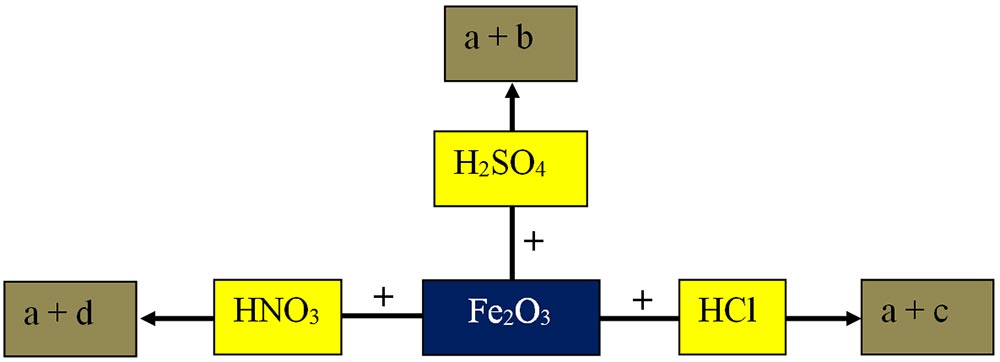
6.11. Se dă următoarea cascadă de reacții chimice. Descoperă formulele chimice ale substanțelor corespunzătoare literelor de la a la h, scrie ecuațiile acestor reacții și tipul fiecărei reacții chimice.
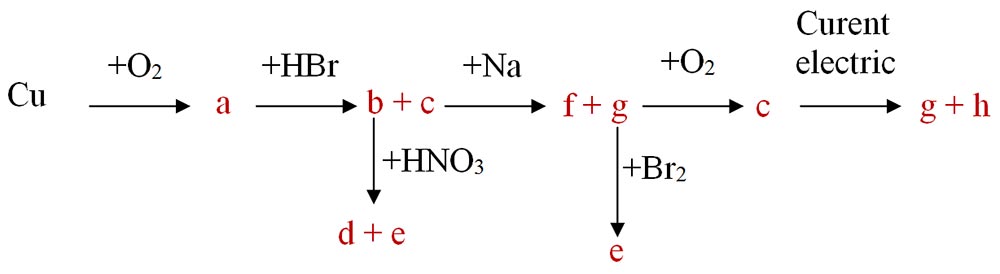
6.12. 300g sol hidroxid de magneziu 20% reacționează cu o soluție de acid azotic 30%. Care este concentrația soluției de sare obținută ?
Test de autoevaluare.
6.13. Scrie formulele chimice ale substanțelor lipsă în locurile punctate, apoi ecuațiile chimice: -2p
a) ZnO + HBr = ...... + H2O
b) CO2 + Mg(OH)2 = MgCO3 + .....
c) HgCl2 + NaOH = NaCl + ......
d) CuS + HI = CuI2 +.....
6.14. Se dau următoarele reacții chimice: -2p
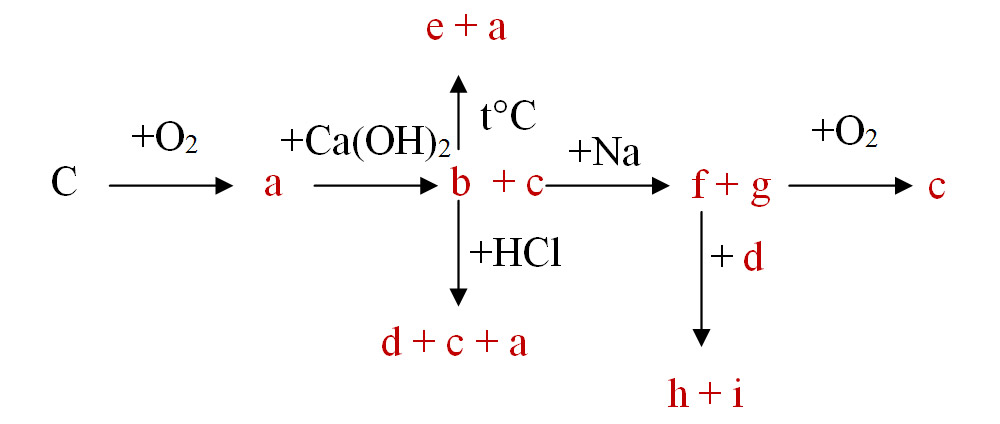
a) Identifică formulele chimice ale substanțelor notate de la litera a până la i.
b) Scrie ecuațiile reacțiilor chimice din această schemă.
6.15. Ce masă de precipitat se obține prin reacția dintre sulfat de cupru și 30 g soluție 40% de hidroxid de potasiu? -2p
Se dau masele atomice: AS = 32 g/mol, AO = 16 g/mol, ACu = 64 g/mol, AH = 1 g/mol, AK = 39 g/mol.
6.16. Ce concentrație are soluția de sare obținută în urma reacției dintre 265 g sol carbonat de sodiu 20% cu o soluție de acid sulfuric 24,5%? -2p
Se dau masele atomice: AS = 32 g/mol, AO = 16 g/mol, AC = 12 g/mol, AH = 1 g/mol, ANa = 23 g/mol.
Oficiu: -2p