Cap.III. Reacția de combinare.
Probleme rezolvate.
3.1. O sârmă de alamă de 70 g conține 60% cupru. Ea este încălzită în flacăra unei spirtiere. Determină masa de oxid de cupru II obținută.
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
2Cu + O2 = 2CuO
-
Aceasta se citește astfel: 2 moli de cupru reacționează cu 1 mol de oxigen și formează 2 moli de oxid de cupru II.
-
-
Aflăm masa de cupru din aliajul său numit alamă:
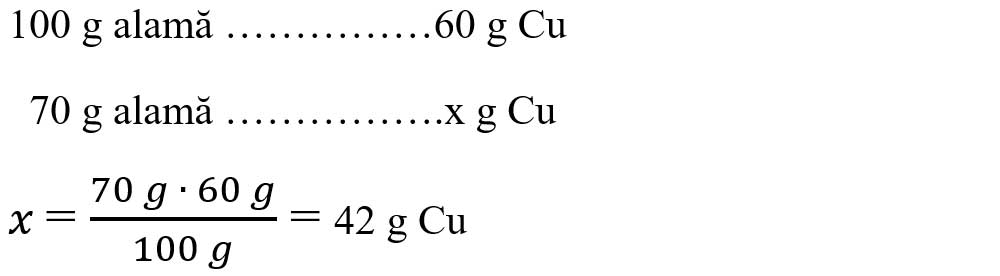
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

-
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
-
Calculăm masa molară a oxidului de cupru II:
-
μCuO = 1∙ ACu + 1 ∙ AO = 64 + 16 = 80 g/mol
-

- Din proporția astfel obținută se calculează necunoscuta:

3.2. 44 g oțel reacționează cu oxigenul la cald. Știind că se obține 60 g magnetită, află procentul de fier și al celuilalt element din oțel.
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
3Fe +2O2 = Fe3O4
-
Aceasta se citește astfel: 3 moli de fier reacționează cu 2 moli de oxigen și formează 1 mol de magnetită.
-
-
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

-
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
-
Calculăm masa molară a magnetitei :
-
μFe3O4 = 3 ∙ AFe + 4 ∙ AO = 3∙ 56 + 4 ∙ 16 = 168 + 64 = 232 g/mol
-
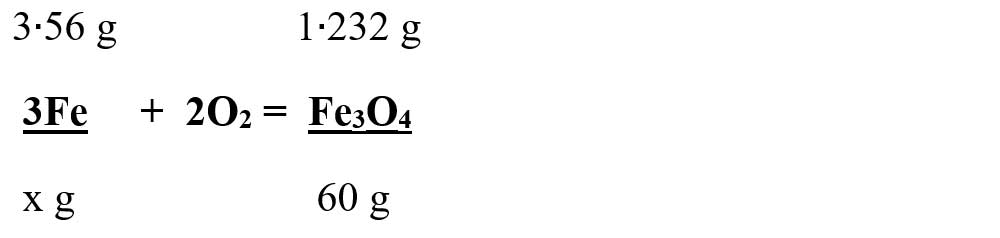
- Din proporția astfel obținută se calculează necunoscuta:

- Aflăm procentul de fier din aliajul său numit oțel, cu regula de trei simplă :
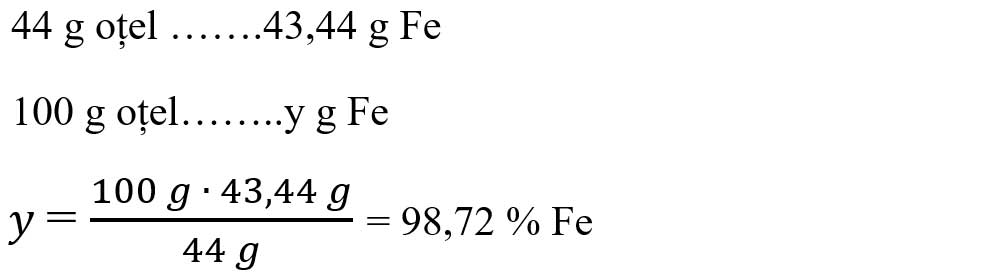
- Oțelul este aliajul fierului cu carbonul. Aflăm procentul carbonului din oțel: 100- 98,72 = 1,28 % C.
3.3. 365 g soluție de acid clorhidric 30% reacționează cu amoniac.
Se cere:
a) Ce masă de clorură de amoniu se obține ?
b) Ce volum de amoniac este necesar pentru a reacționa cu acidul clorhidric ?
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
HCl + NH3 = NH4Cl
-
Aceasta se citește astfel: 1 mol de acid clorhidric reacționează cu 1 mol de amoniac și formează 1 mol de clorură de amoniu.
-
-
Aflăm masa de acid clorhidric din soluția dată:
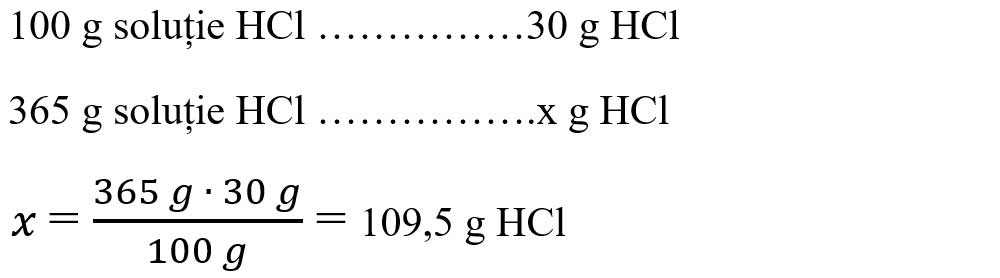
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
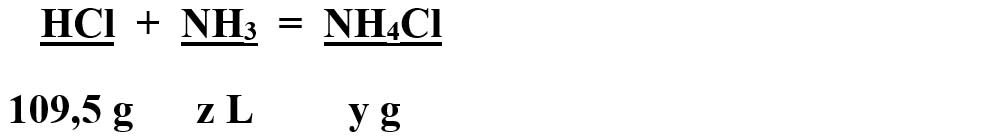
-
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
-
Calculăm masa molară a HCl și NH4Cl :
-
μHCl = 1∙ AH + 1 ∙ ACl = 1 + 35,5 = 36,5 g/mol
-
μNH4Cl = 1∙ AN + 4 ∙ AH + 1 ∙ ACl = 14 + 4 ∙ 1 + 35,5 = 53,5 g/mol
-
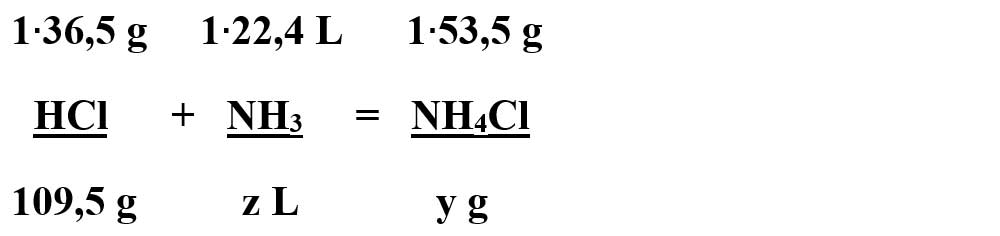
- Din proporțiile astfel obținute se calculează necunoscutele:
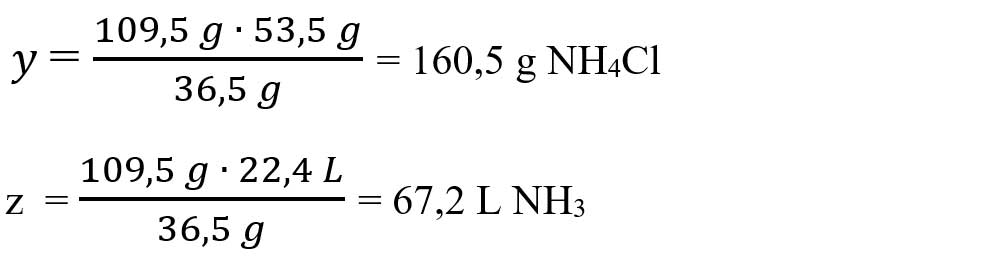
3.4. 20 L clor reacționează cu 11,2 L hidrogen.
Se cere:
a) Ce reactant este în exces și care este excesul de volum al acestuia?
b) Masa acidului clorhidric obținut.
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
Cl2 + H2 = 2HCl ↑
-
Aceasta se citește astfel: 1 mol de clor reacționează cu 1 mol de hidrogen și rezultă 2 moli de acid clorhidric.
-
-
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

-
Calculăm masa molară a HCl:
- μ HCl = 1 ∙ AH + 1 ∙ ACl = 1 ∙ 1 + 1 ∙ 35,5 = 36,5 g/mol
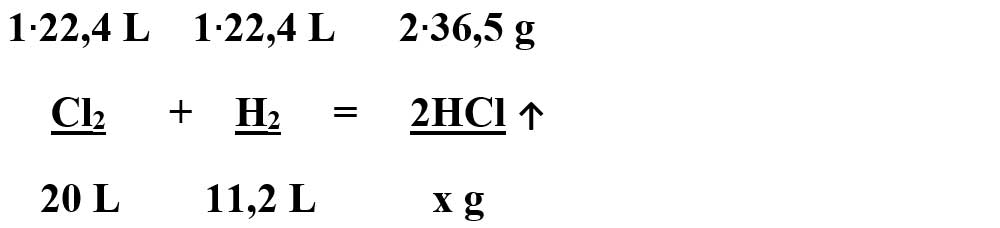
-
Deoarece 1 mol de clor reacționează cu 1 mol de hidrogen, înseamnă că clorul este în exces. Clorul trebuie să aibă același volum cu cel al hidrogenului.
- Vexces = 20 L – 11,2 L = 8,8 L exces Cl2
-
Din proporțiile astfel obținute se calculează necunoscutele:

3.5. 168 g fier reacționează cu 112 L clor.
Se cere:
a) Ce reactant este în exces și care este excesul de volum al acestuia?
b) Excesul de masă al reactantului.
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
2Fe + 3Cl2 = 2FeCl3
-
Aceasta se citește astfel: 2 moli de fier reacționează cu 3 moli de clor și rezultă 2 moli de clorură de fier III.
-
-
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

-
Calculăm masa molară a Cl2:
- μ Cl2 = 2 ∙ ACl = 2 ∙ 35,5= 71 g/mol
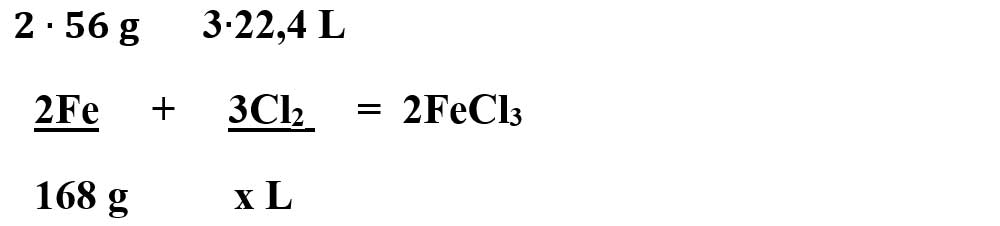
-
Calculăm raportul molar al reactanților conform ecuației chimice:
- υ1 Fe : υ2 Cl2 = 2 : 3
-
Calculăm numărul de moli al fiecărui reactant din datele problemei:
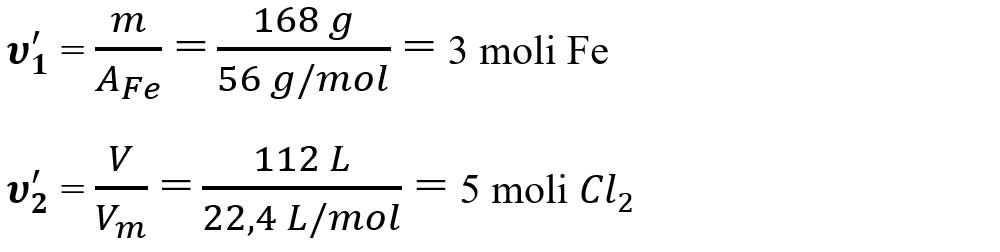
- Calculăm volumul de clor care trebuie să reacționeze cu 168 g Fe, din ecuația chimică:
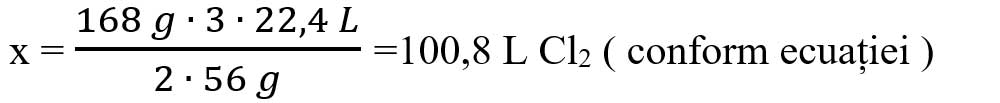
-
Calculăm volumul de clor în exces:
- Vexces = 112 L – 100,8 L = 11,2 L exces Cl2
-
Calculăm excesul de moli de clor:
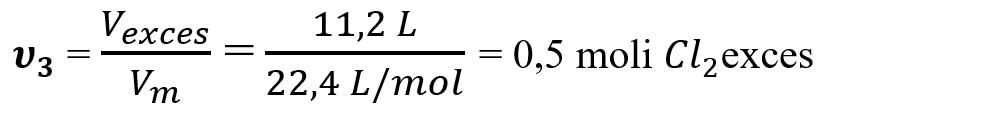
- Calculăm masa de clor în exces din formula nr. de moli:
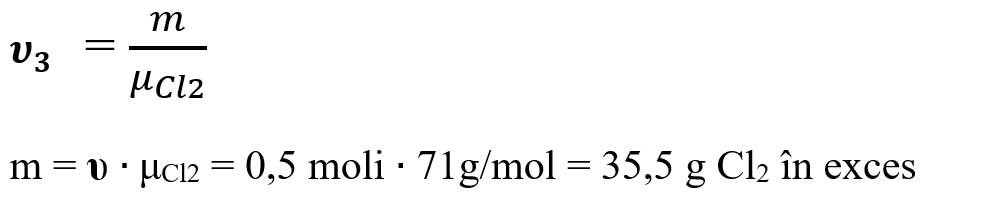
Exerciții.
3.6. Completează următoarele afirmații:
a) Reacția de combinare este reacția în care se obține…………………produs de reacție.
b) Schema reacției de combinare este :
c) Reactanții pot fi atât substanțe …………………, cât și substanțe ……………… .
d) …………………………………… este întotdeauna o substanță compusă.
3.7. Completează formulele chimice ale substanțelor lipsă și apoi scrie ecuațiile chimice:
a) Br2 + H2 → …….
b) Ag + ….. → Ag2O
c) MgO + H2O →……
d) NO + O2 → NO2
e) …… + H2 → HF
f) HCl + NH3 → ….
g) Ca + I2 → ……
h) …… + F2 → ZnF2
i) Al + S →…….
j) …… + O2 → Fe3O4
3.8. Calculează masa de clorură de cupru obținută în urma reacției dintre 450 g fier de puritate 70% cu clorul. Ce volum de clor trebuie introdus în reacție?
3.9. 40 L hidrogen reacționează cu 90 g fluor. Se cere:
a) Care reactant este în exces ?
b) Excesul reactantului.
c) Volumul de acid fluorhidric obținut.
Test de autoevaluare.
3.10. Completează formulele chimice ale substanțelor lipsă și apoi scrie ecuațiile chimice: 8spații libere x 0,25p = 2p
a) I2 + H2 → …….
b) HCl + NH3 → ….
c) Fe + O2 → ……
d) K + S → …….
e) Zn + ….. → ZnO
f) CaO + H2O →……
g) SO2 + ……→ SO3
h) …… + H2 �→ HBr
3.11. Se dă următoarea schemă:

a) Determină reactanții cu care hidrogenul reacționează pentru a forma substanțele chimice din schemă. -0,75p
b) Scrie ecuațiile chimice ale celor trei reacții chimice. -0,75p
c) Ce mase de amoniac, metan, respectiv acid fluorhidric se obțin din 20g de hidrogen? Se dau masele atomice: AH = 1, AN = 14, AC = 12, AF = 19. -1,5p
3.12. 67,2 L de dioxid de carbon reacționează cu apa. Ce masă de sifon se obține? Se dau masele atomice: AH = 1, AC = 12, AO = 16. -1,5p
3.13. Ce masă de bromură de cupru se formează din 400 g cupru de puritate 80%? Se dau masele atomice: ACu = 64, ABr = 80. -1,5p
Oficiu -2p