Cap.IV. Reacția de descompunere.
Probleme rezolvate.
4.1. Într-un vas avem 9066,67 g soluție de apă oxigenată 3%. Vasul se lasă descoperit și la lumină pentru a descompune apa oxigenată.
Se cere:
a) Câți litri de oxigen se degajă ?
b) Ce masă de apă rămâne în vas după descompunerea completă a apei oxigenate ?
Rezolvare:
-
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
-
2H2O2 = 2H2O + O2 ↑
-
Aceasta se citește astfel: 2 moli de apă oxigenată se descompune în 2 moli de apă și 1 mol de oxigen.
-
-
Aflăm masa de apă oxigenată din soluția dată :
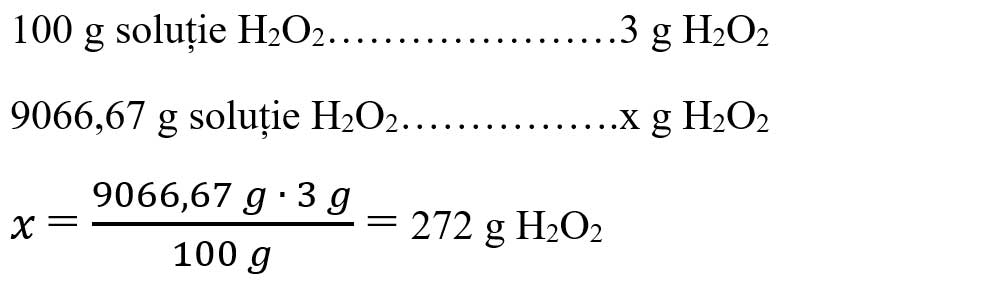
- Citim datele problemei și subliniem substanțele care se dau �și cele care se cer și le trecem sub substanțe:

-
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
-
Calculăm masa molară a H2O2 și a H2O :
-
μ H2O2 = 2 ∙ AH + 2 ∙ AO = 2 ∙ 1 + 2 ∙ 16 = 34 g/mol
-
μ H2O = 2 ∙ AH + 1 ∙ AO = 2∙ 1 + 1 ∙ 16 = 18 g/mol
-
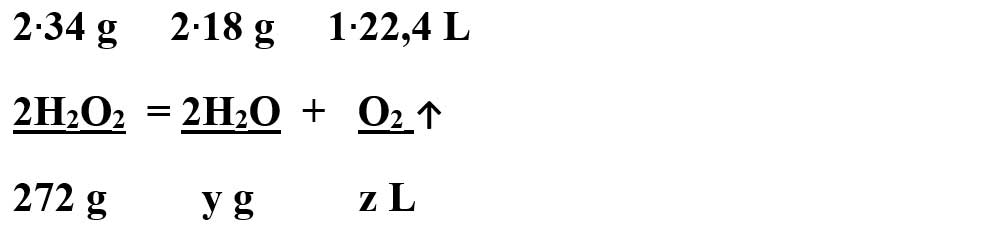
- Din proporțiile astfel obținute se calculează necunoscutele:

9066,67 g soluție H2O2 – 272 g H2O2 = 8794,67 g H2O din soluția inițială
Masa de apă rămasă în vas = 8794,67 g H2O din soluția inițială + 144 g H2O rezultată în urma reacției de descompunere = 8.938,67 g H2O

4.2. Varul (CaO) se obține prin descompunerea termică a calcarului (CaCO3). Calculează masa de CaO care se obține din 500 kg de calcar, dacă transformarea lui are loc cu un randament de 95%.
Rezolvare:
- Determinăm masa de substanță transformată, folosind formula randamentului:

-
Calculăm masele molare ale CaCO3 și CaO:
-
μ CaCO3 = 1 ∙ ACa + 1 ∙ AC + 3 ∙ AO = 40 + 12 + 3 ∙ 16= 100 kg/kmol
-
μ CaO = 1 ∙ ACa + 1 ∙ AO = 40 + 16= 56 kg/kmol
-
-
Scriem datele problemei pe ecuația chimică și calculăm masa CaO obținută:
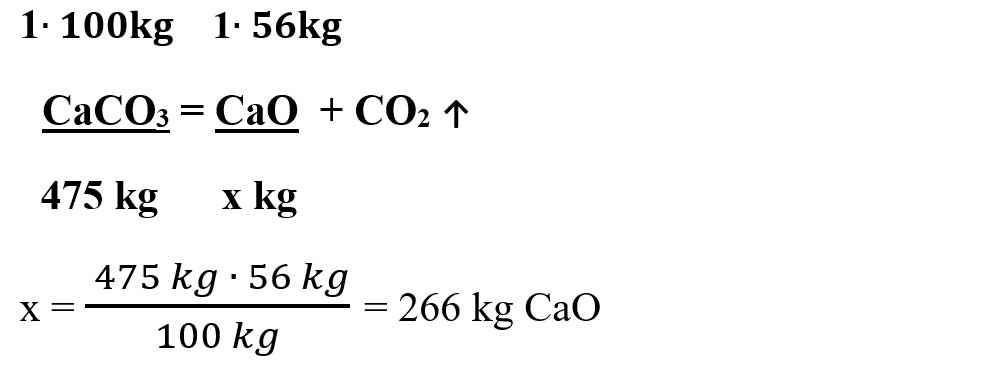
Exerciții.
4.3. Completează următoarele afirmații:
a) Reacția de descompunere este reacția în care avem un singur ……………………… .
b) Schema reacției de descompunere este : ……………………………………… .
c) Reactantul este întotdeauna o substanță ………………………………………………… .
d) Produșii reacției pot fi atât substanțe ……………………, cât și substanțe ………………………… .
4.4. Completează formulele chimice ale substanțelor lipsă și scrie ecuațiile chimice:
a) AgCl → ........ + Cl2 ↑
b)...... → CaO + CO2 ↑
c)Cu(OH)2 → ........ + H2O ↑
d) H2O → 2H2↑ + ………………
e) H2O2 →........ + O2 ↑
f) CuCO3 → CuO + .........
4.5. Ce puritate are piatra de var (carbonat de calciu cu impurități), dacă în urma descompunerii sale s-au obținut 280 kg de var (oxid de calciu)?
4.6. Ce masă de argint se obține în urma descompunerii a 200 g soluție de clorură de argint 40% .
Test de autoevaluare.
4.7. Completează formulele chimice ale substanțelor lipsă și scrie ecuațiile chimice: -2p
a) AgBr → Ag + ......
b) MgCO3 → MgO + .......
c) H2O → O2 ↑ + ……………………
d) ........ → CuO + CO2 ↑
4.8. Se dă următoarea schemă: -2p
H2O2 → a + b ↑
a → c ↑ + b ↑
b + Zn → d
c + Br → e
HgO → b↑ + f
a) Identifică formulele chimice ale substanțelor a, b, c, d, e și f.
b) Scrie ecuațiile chimice din schemă.
4.9. Ce masă de oxid de calciu se obține prin descompunerea a 200 kg de carbonat de calciu de puritate 80%? -2p
4.10. Ce masă de apă se găsește într-un vas în care a avut loc descompunerea a 500 g apă oxigenată 15% și ce volum de gaz s-a degajat? -2p
Oficiu –2p